MANCHAS PÓS-GOLDINCISION®

Conteúdo extraído do livro “Vitória Contra a Celulite” do Dr Roberto Chacur, Ed. AGE, 2023.
Dr. Roberto Chacur
MANCHAS PÓS-GOLDINCISION®
Pele
A pele é um órgão complexo e dinâmico, constantemente variável. É responsável por aproximadamente 15% da superfície corporal de uma pessoa adulta e, além disso, regula a temperatura corporal e protege contra agentes físicos, químicos e biológicos. Consiste de três camadas principais: a epiderme, a derme e a hipoderme (camada subcutânea). Cada uma delas é composta por várias subcamadas. Os apêndices da pele, tais como folículos pilosos e glândulas sebáceas e sudoríparas, também desempenham uma função global.
Epiderme (camada mais externa)
Avascular e com função de barreira semipermeável, a epiderme é, de forma básica, um tecido epitelial estratificado, queratinizado, constituído de células epiteliais escamosas, que estão em constante processo de renovação.
As terminações nervosas e os corpúsculos sensoriais situam-se na camada basal.
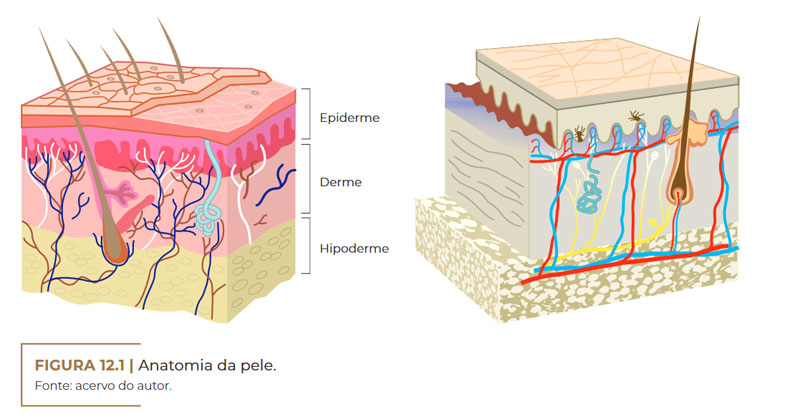
Anatomia da pele. Fonte: acervo do autor
Ver Capítulos
CAPÍTULO 2 – CLASSIFICAÇÃO DA CELULITE
CAPÍTULO 5 – MODELAMENTO DE GLÚTEOS
CAPÍTULO 6 – TRATAMENTOS INJETÁVEIS PARA CELULITE
CAPÍTULO 7 – LASER-LIPO: TECNOLOGIA INVASIVA
CAPÍTULO 8 – OUTROS TRATAMENTOS PARA CELULITE
CAPÍTULO 9 – EFEITOS BIOESTIMULADORES
CAPÍTULO 10 – INFLUÊNCIA DOS HORMÔNIOS
CAPÍTULO 11 – GOLDINCISION®: UMA ABORDAGEM MULTIFATORIAL NO TRATAMENTO DA CELULITE
CAPÍTULO 12 – MANCHAS PÓS-GOLDINCISION ®
CAPÍTULO 13 – EFEITOS ADVERSOS E INTERCORRÊNCIAS NA GOLDINCISION®
Com a colaboração de colegas médicos experientes, o Dr. Roberto Chacur reúne neste livro uma abordagem em torno do tema, que vai desde a gênese da celulite, sua avaliação e classificação, doenças associadas, modulação hormonal, tratamentos existentes, o que realmente funciona e por qual motivo o GOLDINCISION é considerado o padrão ouro no tratamento da celulite.
Derme (camada intermediária)
A derme é a camada de tecido conjuntivo composta por um sistema integrado de estruturas fibrosas, filamentosas e amorfas, na qual estão os vasos sanguíneos, os nervos e os anexos epidérmicos. É na derme que estão localizados os folículos pilosos, os nervos sensitivos, as glândulas sebáceas, responsáveis pela produção de sebo, e as glândulas sudoríparas, responsáveis pelo suor (AZULAY, 2017; SBD, c2016).
Hipoderme (camada mais profunda)
A hipoderme é a camada mais profunda da pele, apresentando os lipócitos, colágenos com vasos sanguíneos, linfáticos e nervos. O número de células presentes nessa camada difere nas diferentes partes do corpo. Além do mais, a distribuição de células adiposas também difere entre homens e mulheres, assim como a estrutura de outras partes da pele.
PIGMENTAÇÃO DA PELE
A pele é o mais visível aspecto do fenótipo humano, e sua cor é um de
seus fatores mais variáveis. Pouco se conhece sobre as bases genéticas,
evolutivas e os aspectos culturais relacionados ao estabelecimento dos
padrões de cor da pele humana.
A síntese de vitamina D na pele, degradação de ácido fólico pela RUV,
resistência à exposição solar direta e elementos culturais são argumen–
tos sobre os quais tentam explicar a distribuição fenotípica da cor da
pele em diferentes latitudes do planeta.
A cor da pele humana normal é principalmente influenciada pela pro–
dução de melanina, um pigmento castanho denso, de alto peso molecu–
lar, o qual assume o aspecto mais enegrecido quanto mais concentrado.
No entanto, pigmentos exógenos amarelos – os carotenoides – tam–
bém contribuem para a coloração da pele, assim como o vermelho endó–
geno, da hemoglobina oxigenada nos capilares da derme e azul endóge–
no, da hemoglobina reduzida nas vênulas.
Em humanos, a pigmentação da pele e dos cabelos é dependente da
atividade melanogênica, dentro dos melanócitos, da taxa de síntese de
melanina, bem como do tamanho, número, composição e distribuição de
partículas do citoplasma dos melanócitos, denominadas melanossomas,
além da natureza química da melanina que elas contêm.
Os melanócitos e os melanossomas têm seu número relativamente
constante em diferentes etnias.
Melanócitos
Os melanócitos são células que derivam da crista neural (melanoblas–
tos) e migram durante a embriogênese para a pele. Esse processo co–
meça entre a décima e a décima segunda semanas de desenvolvimen–
to do feto para a derme, e duas semanas mais tarde para a epiderme,
onde eles se diferenciam em melanócitos, os quais por volta do sexto
mês da vida fetal se dispõem na junção dermo-epidérmica (HEARING;
TSUKAMOTO, 1991). Várias citocinas e fatores de crescimento são acei–
tos como suporte para diferenciação de melanoblastos para melanócitos
e sua migração.
A associação entre um melanócito com 36 queratinócitos constitui a
unidade melano-epidérmica (DUVAL et al., 2002). Os melanócitos alcan–
çam sítios específicos, dentre eles: derme, epiderme, folículos pilosos,
trato uveal do olho, vestíbulo e saco endolinfático do ouvido, leptome–
ninges do cérebro.
De acordo com HEARING; TSUKAMOTO (1991), os melanócitos sin–
tetizam a melanina dentro de organelas, chamadas melanossomos, os
quais podem variar em tamanho, número e densidade, sendo posterior–
mente transferidos para os queratinócitos e bulbos de cabelo. Os mela–
nócitos são influenciados por uma variedade de fatores extracelulares
determinantes para o início da síntese e o tipo de melanina a ser pro–
duzido. A síntese e a distribuição de melanina na epiderme envolvem
vários passos: transcrição de proteínas necessárias para a melanogê–
nese, biogênese de melanossomos, triagem de proteínas melanogênicas
dentro de melanossomos, transporte de melanossomos para as bordas
dos dendritos dos melanócitos e transferência de melanossomos para os
queratinócitos (PARK et al., 2008).
Dentro dos melanossomos há três enzimas que são absolutamente
necessárias para sintetizar os vários tipos de melanina. Enquanto a tirosinase é
responsável pela etapa crítica da melanogênese (passo limi–
tante da biossíntese, hidroxilação da tirosina), a proteína relacionada à
tirosinase-1 (TRP-1), e a dopacromo, a tautomerase (DCT) estão mais
envolvidas com a modificação da melanina em diferentes tipos. Além
dessas, os melanossomos contêm outras proteínas melanócito-específi–
cas, que têm funções estruturais ou estão envolvidas na regulação do pH
dentro dos melanossomos, como a proteína P ou a proteína transporta–
dora associada à membrana (MATP) (COSTIN; HEARING, 2007).
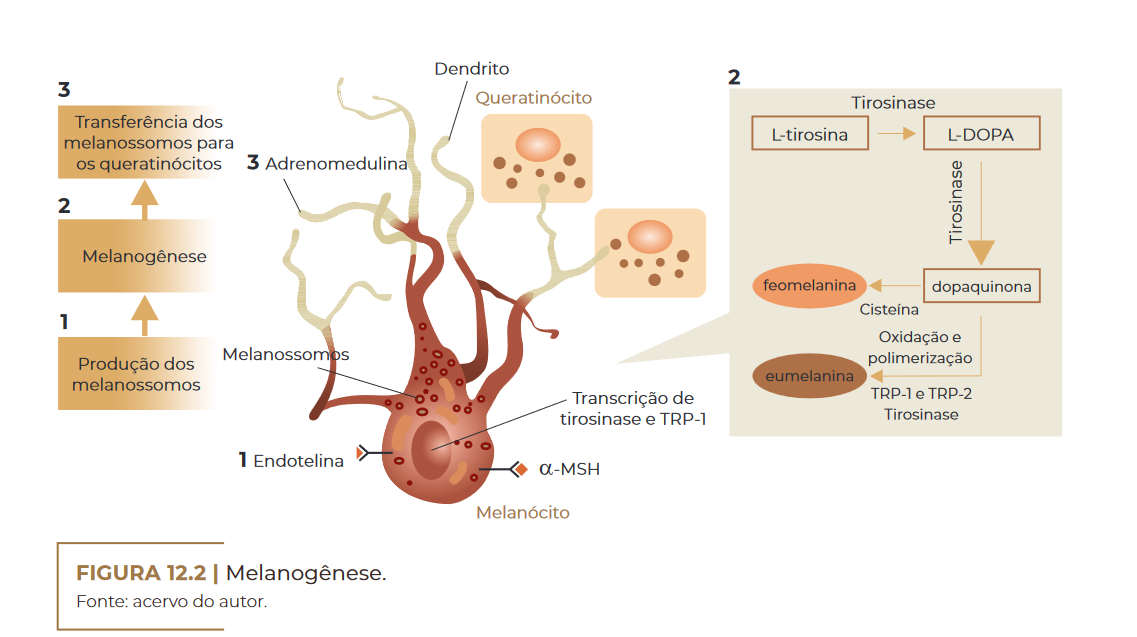
Melanogênese. Fonte: acervo do autor
Melanina
A pigmentação de pele, olhos e cabelo depende de uma grande varieda–
de de fatores que influenciam a função de melanócitos em vários níveis.
Há uma grande quantidade de genes que afetam todos os níveis da mela–
nogênse, direta ou indiretamente. Muitos desses genes codificam proteí–
nas que estão localizadas nos grânulos de melanina, que cumprem papel
importante na estruturação e no funcionamento dessas organelas, tanto
função catalítica na síntese de melanina como função estrutural na in–
tegridade dos melanossomos. Muitos desses genes têm sido implicados
em diversas desordens de pigmentação herdadas geneticamente (HEA–
RING, 2006).
O pigmento melanina tem vasta gama de importantes funções fisio–
lógicas, como proteção dos tecidos subjacentes expostos à radiação ul–
travioleta (UV), controle de temperatura e produção de coloração adap–
tativa na pele (PROTA, 1980), seu papel principal na pele humana serve
para atenuar a penetração de raios UV em proporções mais profundas,
como em vasos sanguíneos da derme (SLOMINSKI et al., 2004).
Além disso, é o maior determinante da coloração da pele huma–
na, sintetizado a partir da L-tirosina. É composto por um pigmento
que varia de marrom a preto, eumelanina, e outro que contém enxo–
fre que varia de vermelho a amarelo, feomelanina (DUVAL et al., 2002),
já Slominski et al. (2004) propõem que há vários tipos de melanina,
como eumelanina, feomelanina, neuromelanina e uma mistura de pig–
mentos melânicos, caracterizando-os como polimorfos e biopolímeros
multifuncionais.
Eumelanina e feomelanina estão firmemente associadas a pro–
teínas, porém exibem diferenças nas propriedades químicas e físicas
na proteção contra a radiação UV. Eumelanina é considerada um po–
límero fotoestável, fotoprotetor, insolúvel na maioria dos solventes;
ao contrário, a feomelanina é solúvel em álcalis, fotolábil, fotossensi–
bilizadora, por produzir radicais superóxido e hidroxila e peróxido
de hidrogênio após radiação solar (DUVAL et al., 2002; SLOMINSKI et
al., 2004).
Os hormônios sexuais estrogênio e progesterona têm sido relatados
por interagir com melanócitos, embora o mecanismo e a diferenciação
não tenham sido esclarecidos. Acredita-se que o aumento da pigmen–
tação frequentemente observada na gravidez é um efeito fenotípico da
produção de estrogênio (HEARING, 2006).
Variações ambientais de temperatura podem influenciar a biologia
da pele humana, consequentemente queratinócitos epidérmicos expos–
tos ao calor, frio ou stress oxidativo, resultam na indução de inflamação
cutânea; por exemplo, o aquecimento leva à formação de interleucinas
1-alfa, prostaglandinas E2 (ALLAPPATT et al., 2000).
Muitos compostos químicos têm demonstrado efeitos inibitórios so–
bre a melanogênese pela inibição da atividade enzimática da tirosina–
se, mas efeitos relacionados com expressão gênica, degradação proteica,
glicosilação, transferência de melanossomos e regulação de sinais celu–
lares também foram reportados no controle da melanogênese (SOLANO
et al., 2006).
DISTÚRBIOS DE PIGMENTAÇÃO (DISCROMIAS)
Dentro dessa ordem de colorações de pele, há desordens do siste–
ma pigmentar, o que resulta em problemas de hiperpigmentação e
hipopigmentação.
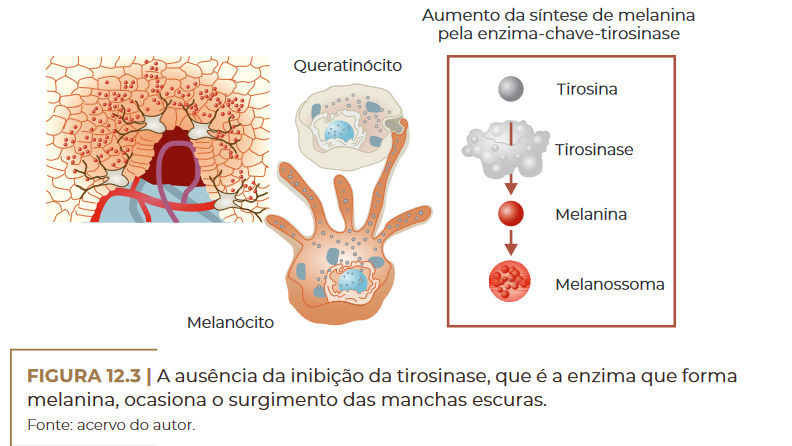
A ausência da inibição da tirosinase, que é a enzima que forma
melanina, ocasiona o surgimento das manchas escuras.
Fonte: acervo do autor
A hiperpigmentação da pele é a queixa mais comum entre pacientes
que consultam dermatologista em busca de restabelecer uma cor homo–
gênea da pele. Podem ser divididas em hiperpigmentação difusa e cir–
cunscrita, linear e reticulada.
Alguns tipos de manchas hipercrômicas são: melasmas (Figu–
ra 12.4A), efélides (Figura 12.4B), cloasmas, melanoses solares (Fi–
gura 12.4C), lentigens senis (Figura 12.4D), melanose de Riehl, po–
liquilodermia de Civatte, melanodermatite por fotossensibilização,
melanodermia residual, hiperpigmentação periorbital, hiperpigmenta–
ção pós-inflamatória. A hiperpigmentação da pele pode ser resultante do aumento na
quantidade de melanina, do aumento do tamanho dos melanossomos e
do aumento no número dos melanócitos, que pode ocorrer devido a vá–
rios fatores, como envelhecimento, gravidez, distúrbios endócrinos, tra–
tamento com hormônios sexuais e exposição ao sol em diferentes graus.
As epidérmicas ocorrem por aumento do número de melanossomos
ou da taxa de melanogênese e apresentam-se com coloração mais amar–
ronzada. Já as hiperpigmentações dérmicas ocorrem por aumento da
deposição de melanina na derme, retida por macrófagos, ou pela eleva–
ção da produção de melanina nos melanócitos dérmicos e se apresentam
com coloração cinza a azul-acinzentada. E, por fim, as hiperpigmenta–
ções mistas, que acometem a epiderme e a derme.
A hiperpigmentação pós-inflamatória é o tipo de hiperpigmentação
adquirida mais comum. É mais recorrente em pessoas de fototipo mais
alto e é resultante de uma inflamação que pode ter sido causada por
qualquer evento inflamatório agudo que, por meio de vários mecanis–
mos, dentre eles a estimulação direta de melanócitos por mediadores in–
flamatórios como a interleucina-1-α, endotelina-1 e espécies reativas de
oxigênio, geradas pelo dano na pele.
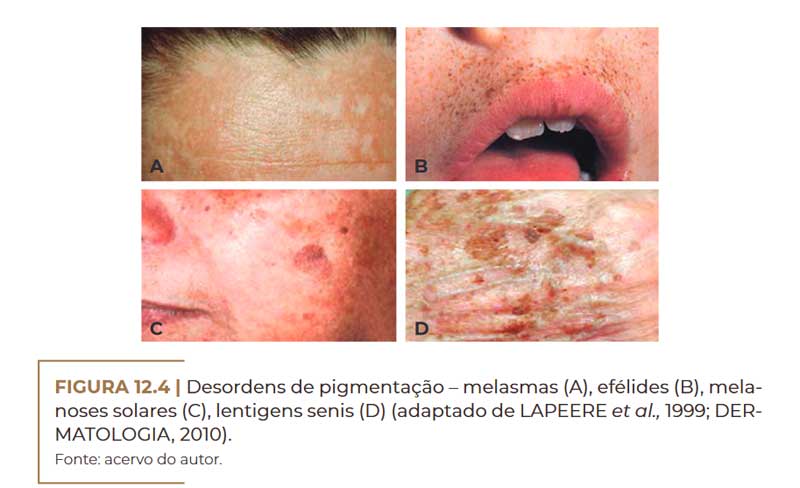
Desordens de pigmentação – melasmas (A), efélides (B), melanoses solares (C), lentigens senis (D) (adaptado de LAPEERE et al., 1999; DERMATOLOGIA, 2010). Fonte: acervo do autor
Além disso, dano de células epidérmicas pode liberar indutores en–
dócrinos de pigmentação, como o hormônio α-MSH. Todos esses fatores
geram hiperpigmentação. A melanina produzida durante o evento in–
flamatório pode entrar na derme, gerando internalização pelos macró–
fagos desse excesso de pigmentação; sendo assim, os macrófagos ficam
represados na derme por longos períodos (ORTONNE, BISSETT, 2008).
As cores das lesões variam da cor marrom à cor negra e à cor cinzenta e,
usualmente, seguem a distribuição da dermatose primária.
A hipercromia por deposição de hemossiderina decorre em função
do rompimento dos vasos sanguíneos, que ocasiona o desenvolvimento
de edema e o acúmulo de hemoglobina na região tratada. A porção férrica
da hemoglobina se liga a uma parte proteica, formando a ferritina (por–
ção de ferro disponível no organismo). A degradação da ferritina libera
os íons férricos, que, desligados da parte proteica, tornam-se tóxicos, e
reagem com o oxigênio, produzindo radicais livres; estes, após complexo
processo, desestabilizam-se, gerando um processo oxidativo em cadeia e
tornando-se reativos. A fim de evitar esse processo, o organismo se protege,
formando a hemossiderina, que é uma espécie de armazenagem do
íon ferro cristalizado acumulado nas células, principalmente do reticulo
endotelial. O resultado é a formação de um composto insolúvel, atóxico,
que se deposita na derme. É constatável histologicamente 24 a 48 horas
após o extravasamento de sangue, com pique entre o 4.° e 5.° dias.
Estudos histológicos demonstram que a pigmentação marrom-acas–
tanhada é causada pela alteração da cor da derme pela hemossiderina.
O pigmento fica predominantemente na derme superficial, podendo, às
vezes, estar presente nas regiões periaxiais ou na derme média. Alguns
autores acreditam que a oxidação do ferro presente nas lesões levaria à
formação de radicais, que, por sua toxidade, estimulariam os melanóci–
tos, piorando as lesões. Verificou-se que o ferro depositou-se na matriz
extracelular entre as fibras de colágeno e dentro de grânulos das células
de Langerhans, dando aspecto marrom à pele, característico da hemos–
siderina (QUEZADA GAÓN et al.).
O procedimento da Goldincision®, pela bioestimulação de colágeno
e pelo rompimento do septo de fibrose; além de liberar a pele, o pro–
cedimento promove a formação de uma coleção de sangue (hematoma)
pelo rompimento de pequenos vasos sanguíneos, abaixo da lesão trata da.
Esse hematoma, além do trauma e do processo inflamatório, vai aju–
dar na produção de um colágeno novo e mais bem organizado, colágeno
que vai preenchendo o local tratado, dando aspecto de relevo mais uni–
forme à pele, além de ela ser mais firme. As máculas residuais são causa
de angústia para muitos pacientes e que parecem ser resultado do depó–
sito de hemossiderina associado à hiperpigmentação melânica, pois se
acredita que haja ativação melanocítica secundária à deposição de pig–
mento férrico na derme.
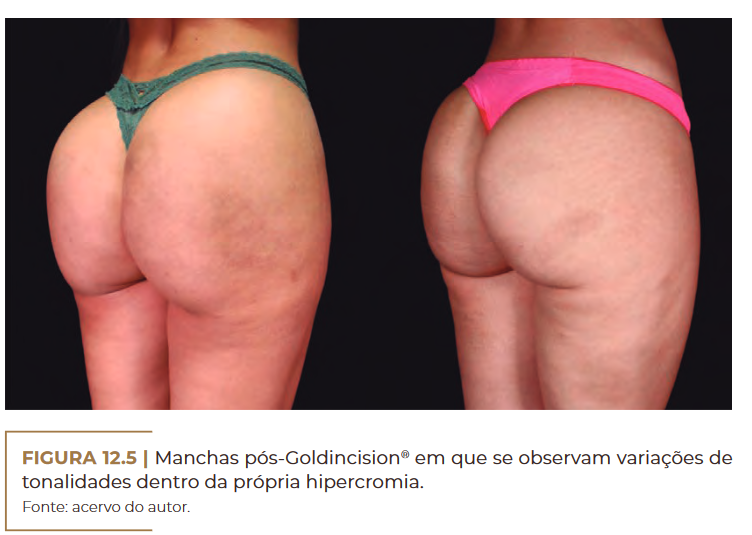
Manchas pós-Goldincision® em que se observam variações de tonalidades dentro da própria hipercromia. Fonte: acervo do autor.
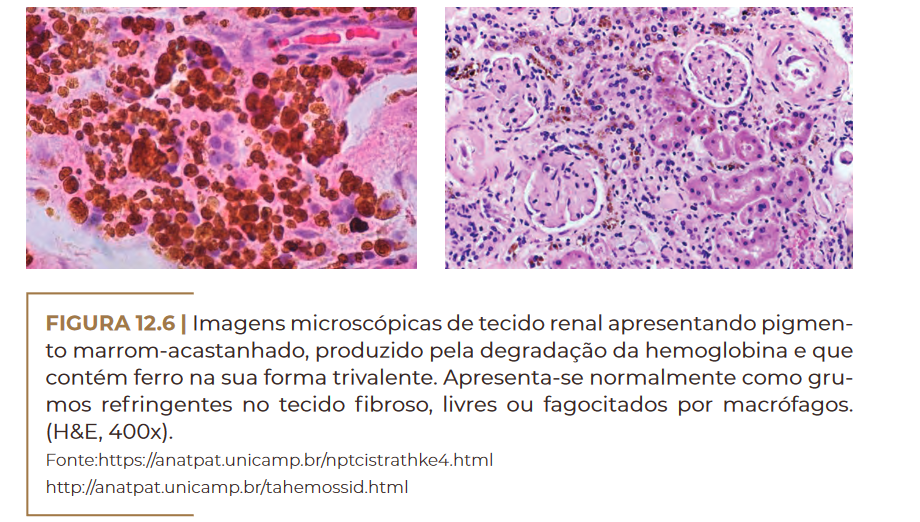
Imagens microscópicas de tecido renal apresentando pigmento marrom-acastanhado, produzido pela degradação da hemoglobina e que
contém ferro na sua forma trivalente. Apresenta-se normalmente como grumos refringentes no tecido fibroso, livres ou fagocitados por macrófagos. (H&E, 400x). Fonte:https://anatpat.unicamp.br/nptcistrathke4.html http://anatpat.unicamp.br/tahemossid.html
FATORES DE ALERTA
Alguns fatores servem de alerta durante a anamnese para aqueles pa–
cientes que terão chance maior de evoluir com as manchas.
Dentre eles pode-se citar a genética – fototipos mais altos tendem a
manchar mais do que os fototipos mais baixos. O tabagismo, o álcool, o
uso de medicamentos vasodilatadores, quimioterápicos e antipsicóticos
são fatores que podem contribuir nesse processo pela estase dos vasos
sanguíneos, favorecendo a mudança de cor na região.
A terapia de reposição hormonal e o uso de anticoncepcionais, as–
sim como antibióticos da classe das tetraciclinas, podem levar ao au–
mento na produção de melanina. Já as doenças que cursam com retenção hídrica, como
tireoidopatias, nefropatias, cardiopatias e pneumopatias,
tendem a manter o hematoma por mais tempo no local, favorecendo a
formação do pigmento de hemossiderina. E a deficiência de vitamina K
também está relacionada ao aumento no tempo de sangramento.
Pacientes em uso de medicações contendo ferro, recomenda-se que
evitem ingerir esses medicamentos, bem como reduzam a ingesta desse
mineral 30 dias antes do procedimento.
O tratamento ideal deve incluir a suspensão de fatores desencadean–
tes quando identificados.
TRATAMENTOS
A notícia boa é que estudos mostraram que essas manchas se resolvem
espontaneamente, sem ajuda de cremes, laser ou qualquer tratamento
que seja. Estima-se que 80% das manchas desaparecem completamente
após um período de 6 a 24 meses.
Entretanto, quanto mais cedo for instituída a terapêutica para a re–
solução do processo inflamatório, melhor e mais precoce será o resulta–
do do tratamento das manchas.
A terapia de primeira linha consiste na utilização de agentes tópi–
cos clareadores, podendo ser associadas tecnologias, incluindo fotopro–
teção, antes, durante e depois do processo terapêutico.
O tratamento para manchas muitas vezes é demorado, e os resulta–
dos podem variar de acordo com a intensidade da lesão. Diversos trata–
mentos são utilizados para tratar esse tipo de hipercromia, como, por
exemplo, o uso de tópicos despigmentantes, indução percutánea de co–
lágeno, o uso de peelings químicos, microagulhamento, tratamento com
laser e luz intensa pulsada (BOMFIM et. al, 2022).
No entanto, é importante estar sempre atento ao potencial que o
próprio tratamento tem de causar ou agravar a HPI, causando irritação.
Agentes clareadores
Os agentes clareadores possuem princípios ativos que atuam por meio
de diferentes mecanismos de ação. Um ponto importante é que todos es–
tão ligados à interferência na produção ou transferência de melanina, seja inibindo a biossíntese de tirosina,
inibindo a formação da melanina,
interferindo no transporte dos grânulos de melanina, alterando quimi–
camente a melanina, destruindo seletivamente os melanócitos e inibin–
do a formação de melanossomas e alteração de sua estrutura.
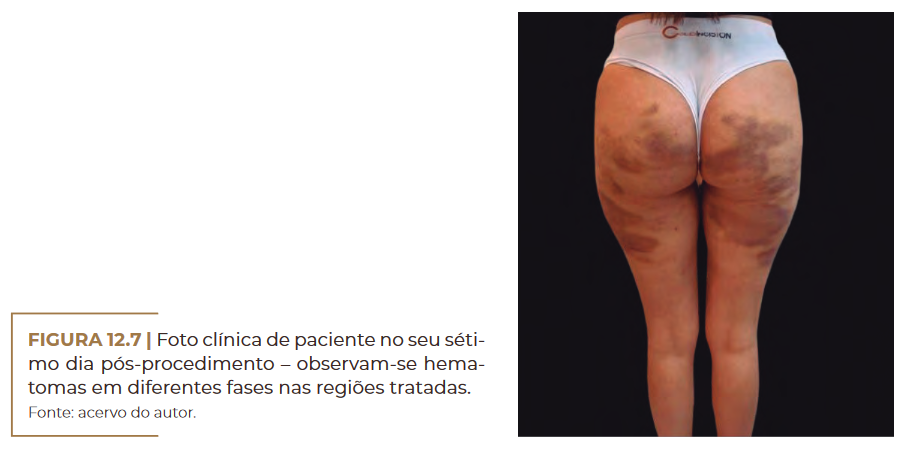
Foto clínica de paciente no seu séti-
mo dia pós-procedimento – observam-se hema-
tomas em diferentes fases nas regiões tratadas.
Fonte: acervo do autor
Sendo assim, os tratamentos para clareamento das hiperpigmenta–
ções devem conter associações de dois ou mais agentes de diferentes
mecanismos para produzir um efeito sinérgico. Além do seu mecanismo
de ação, outros parâmetros relacionados com citotoxicidade, solubilida–
de, absorção cutânea, penetração e estabilidade dos agentes de trata–
mento devem ser considerados.
Sabe-se que o tratamento da pele discrômica é, de certa forma, di–
fícil, pois muitos compostos efetivos no tratamento apresentam pro–
priedades irritantes e podem, em certos casos, promover descamação.
O resultado satisfatório não é conseguido imediatamente, pois a despig–
mentação é gradual.
• EXTRATO DE UVA-URSI: rico em Arbutin natural (Beta-Arbutin).
Capaz de provocar a descoloração da melanina já formada e de
inibir a formação de nova melanina. Inibe o processo de escure–
cimento, reduz efetivamente a pigmentação já existente, além de
possuir a capacidade de inibir em 100% a tirosinase e degradar
naturalmente a melanina presente na pele. A ação da uva-ursi é um pouco mais lenta, porém acumulativa (não reversível) quan–
do comparada com a hidroquinona, ou seja, ao conseguir o cla–
reamento desejado, as manchas não irão reaparecer em seguida
(FÁBIO BORGES).
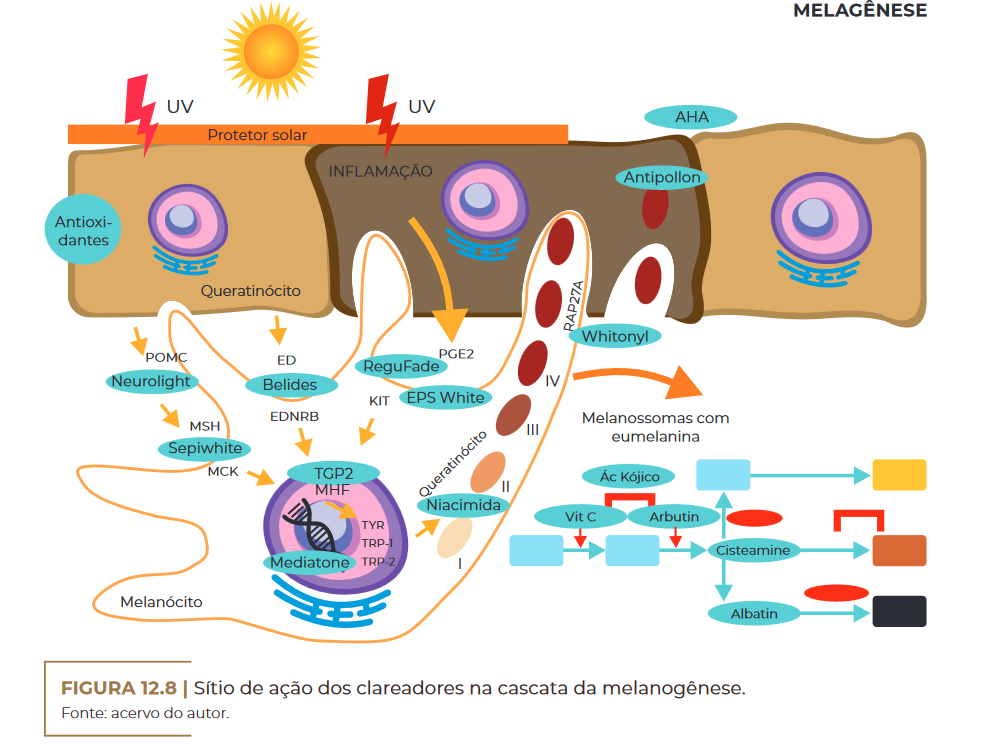
Sítio de ação dos clareadores na cascata da melanogênese.
Fonte: acervo do autor
• HALOXYL: é um ativo composto por matriquinas, que estimulam
a síntese dos componentes da matriz extracelular (MEC). A crisi–
na e o nhidroxi-succinimida agem como quelantes de bilirrubina
e ferro, respectivamente, diminuindo a pigmentação local.
• ÁCIDO TIOGLICÓLICO: ou ácido mercapto ac ético, muito utiliza–
do para o tratamento de hematomas persistentes. Sua afinida–
de pelo ferro e para o tratamento de hematomas persistentes é
semelhante à apoferritina, tendo a capacidade de quelar o ferro da hemossiderina,
por apresentar um grupo tiólico (SH). É usado
topicamente em domicílio na concentração de 5 a 10%. Orientar
uma fina camada por 20 a 30 minutos e retirar em seguida.
• ARBUTIN: derivado natural e estável da hidroquinona, ligado a
uma D-glicose (açúcar). Amplamente utilizado para o tratamen–
to despigmentante de peles sensíveis, fototipos elevados e áreas
sensíveis (VANZIN et al., 2011). Age bloqueando a ação da enzi–
ma tirosinase, impedindo a produção de melanina no ponto de
aplicação. Apresenta menos probabilidade de provocar hiperpig–
mentação irreversível. A forma potencializada α-Arbutin causa
efeito despigmentante de forma mais rápida, eficiente e também
segura. A concentração usual de α-Arbutin varia de 0,2 a 2%.
• ÁCIDO KÓJICO: obtido a partir da fermenta ção do arroz. Tem efei–
to inibidor sobre a tirosinase, por quelação dos íons cobre e, con–
sequentemente, diminuição da síntese de melanina. Induz, ainda,
a redução da síntese de eumelanina em células hiperpigmenta–
das. É uma excelente alternativa despigmentante para o trata–
mento de fotótipos mais elevados, especialmente quando asso–
ciado com ácido fítico. A concentração usual de ácido kójico pode
variar de 1 a 5%.
• SEPIWHITE MSH: diminui a atividade da enzima tirosinase, re–
duz a produção e a fixação da eumelanina nos queratinócitos.
Bloqueia receptores na ligação do hormônio melatropina. Esse
hormônio está diretamente envolvido no estímulo da enzima ti–
rosinase na síntese de melanina (em especial eumelanina), tam–
bém é responsável por favorecer a fixação do pigmento formado
nos queratinócitos, aumentando a luminosidade da pele (VAN–
ZIN et al.).
• ANTIPOLLON: é um despigmentante interessante, pois age na
adsorção e eliminação da melanina já formada, podendo ser as–
sociada a outras substâncias, exceto os ácidos graxos. Pode ser
indicado no tratamento despigmentante de gestante ou de pa–
cientes intolerantes ao uso de despigmentante convencionais.
• ÁCIDO FÍTICO: é o hexafosfato de inositol, substância presente
em cereais e exercem ação inibidora sobre a tirosinase. Tem tam–
bém ações anti-inflamatória, antioxidante, hidratante e quelante.
Além da indicação para o tratamento de hipercromias decorren–
tes do depósito de melanina, devido à ação quelante que o ácido
apresenta, é especialmente indicado para o tratamento de hiper–
cromias causadas pelo depósito de hemossiderina, pela sua po–
tente ação de quelante para o íon ferro.
• VITAMINA C: é o ácido ascórbico, que baixa a estabilidade quími–
ca em soluções aquosas, oxidando facilmente em géis, géis creme
ou emulsões óleo em água (PEYREFITTE, 1998). Investiu-se na ob–
tenção de derivados da vitamina C que exercessem as mesmas fun–
ções, e em contrapartida possuíssem maior estabilidade química
e penetração cutânea em níveis mais eficazes, a fim de que não
ocorra comprometimento das funções farmacodinâmicas (GON–
ÇALVES, 2002). Dessa forma, a vitamina C pode apresentar-se de
várias formas em produtos com a finalidade clareadora, agindo na
síntese de melanina (inibição da tirosinase), antioxidante, e na sín–
tese de colágeno, melhorando a aparência da epiderme.
• BELIDES: Belis perennis é um ativo despigmentante cujo efeito
ocorre antes mesmo de a melanina ser formada, pois diminui a
ação de endotelina 1, um mediador inflamatório produzido nos
queratinócitos e que ativa os melanócitos. Outro mecanismo é a
diminuição da ligação de α-MSH (melanocyte stimulating hormo–
ne) nos melanócitos e consequente diminuição na produção da
eumelanina. Reduz ainda a transferência dos melanossomas for–
mados no melanócito para as células epidérmicas que estão ao
seu redor, diminuindo sua pigmentação. É indicado no tratamen–
to de hipercromias decorrentes do depósito de melanina, como
único ativo despigmentante ou associado a outros produtos,
como a hidroquinona. Sua concentração de uso é de 2,0 a 5,0%.
• VITAMINA K: a vitamina K é fundamental para a síntese de fato–
res da coagulação sanguínea. Encontra-se na lista de substâncias
que não devem fazer parte da composição de produtos cosméti–
cos desde 2010.
• ALGOWHITE: é um despigmentante que atua pela redução da
atividade da endotelina 1 nos melanócitos e pela inibição da
enzima tirosinase; acelera a diferenciação celular e tem efeito
antioxidante.
• WHITESSENCI: esse extrato permite o clareamento de hipercro–
mias derivadas de melanina pela diminuição da fogocitose de
melanossomas, ou seja, diminui a fixação da melanina formada
nos queratinócitos. Contém proteínas de ação clareadora, como
jacalin e artocapin.
• HIDROQUINONA: composto fenólico que inibe a oxidação enzi–
mática da tirosina e de outros processos metabólicos dos mela–
nócitos. É um agente despigmentante de baixo custo e de rápida
resposta clareadora. Devido aos efeitos colaterais, a hidroquino–
na é proibida em vários países.
• ÁCIDO AZELAICO: dispõe de vários mecanismos pelos quais des–
pigmenta a pele, incluindo a inibição da tirosinase, bem como
efeitos citotóxicos e antiproliferativos seletivos para melanócitos
anormais por meio da inibição da síntese de DNA e enzimas mi–
tocondriais. As formulações disponíveis incluem um gel de 15%
ou creme a 20%.
• CISTEAMINE 5%: é um dos mais recentes produtos para clarea–
mento da pele. Acredita-se que o efeito clareador da pele seja de–
vido às suas propriedades antioxidantes inerentes, causando um
efeito clareador na camada córnea. Há a hipótese de que a cistea–
mina reduz a produção de melanina ao inibir as principais enzi–
mas melanogênica, tirosinase e peroxidase, bem como os íons de
cobre quelantes necessários na melanogênese.
• NIACINAMIDA: derivado fisiologicamente ativo da vitamina B3
(niacina), diminui significativamente a transferência de mela–
nossoma para os queratinócitos sem inibir a atividade da tirosi–
nase ou a proliferação celular. Também pode interferir na via de
sinalização celular entre os queratinócitos e os melanócitos para
diminuir a melanogênese. Uma das vantagens da niacinamida é
sua estabilidade não ser afetada por luz, umidade, ácidos, álcalis
ou oxidantes. A niacinamida tópica de 2 a 5% mostrou alguma
eficácia quando usada sozinha ou em combinação.
• ANTAGONISTA DA TIROSINASE: ativos que mimetizam estrutu–
ralmente a tirosina, ocupando o espaço na enzima tirosinase, im–
pedindo sua ação. Ex.: arbutin, hidroquinona, uva ursi.
• ANTIOXIDANTES: dificultam o passo de oxidação da tirosina, di–
minuem o processo inflamatório, combatem os radicais livres,
diminuem as agressões às membranas das células. Ex.: vitamina
C, ácido ferúlico, vitamina E.
• QUELADORES DE ÍONS COBRE: a tirosinase é uma metaloproteí–
na, portanto precisa de metais como cofator. O cobre é um metal
fundamental para o funcionamento dessa enzima. Ao quelar esse
metal a tirosinase tem dificuldades de atuação, diminuindo este
passo da melanogênese. Ex.: ácido kójico, ácido fítico.
• BOOSTER DE GLUTATIONA: a glutationa é uma enzima antioxi–
dante endógena importante para desviar a síntese de melanina
para a formação da feomelanina (amarela), diminuindo a produ–
ção da eumelanina (marrom e preta). Ex.: NAC, cisteamina.
• INIBIDOR DA TRP-2: enzima responsável por acelerar o passo de
formação da eumelanina preta. Ex.: albatin.
• INIBIDOR DA TRANSFERÊNCIA DO MELANOSSOMA PARA OS
QUERATINÓ CITOS: impede que o melanossoma cheio de mela–
nina madura seja entregue ao queratinócitos para pigmentar seu
citoplasma. Ex.: niacinamida, Whitessence.
• INIBIDOR DA RAB27A: essa glicoproteína é fundamental para
transportar o melanossoma pelos filamentos de actína para ser
transferido aos queratinócitos. Ex.: Whitonyl.
• ADSORVEDOR DE MELANINA FORMADA: dispersa e adsorve o pig–
mento de melanina formado nos queratinócitos. Ex.: Antipollon HT.
• ESFOLIANTES QUÍMICOS: removem o estrato córneo im–
pregnado de melanina na camada mais externa da pele. Ex.:
alfahidróxi-ácidos.
• INIBIDOR DA SÍNTESE DE TIROSINASE: inibição de genes que
ativam a melanogênese via núcleo do melanócito. Ex.: Mediatone
ou O.D.A White.
• INIBIDOR DO FATOR DE TRANSCRIÇÃO DERIVADO DA MICROFI–
TALMIA MITF: fator de transcrição importante para iniciar a me–
lanogênese. Ex.: TGP2 peptide, Whiteris G.
• ANTAGONISTA DO ALFA MSH: principal hormônio ativador da
melanogênese. Ex.: Sepiwhite, IluminScan, Delentigo.
• ANTAGONISTA DA ENDOTELINA: a endotelina-1 é o principal
mediador da melanogênese sensível à ativação por radiação UV.
Ex.: Belides, AlgoWhite.
• ANTAGONISTA DO SCF E GM-SCF: os queratinócitos são capazes
de estimular a melanogênese por meio de mediadores e fatores
de estimulação de colônia. Ex.: Regu-Fade.
• INIBIDOR DA PGE-2: as prostaglandinas inflamatórias são esti–
muladoras eficazes da melanogênese, principalmente na hiper–
pigmentação pós-inflamatória. Ex.: EPS White, Physasun.
• BLOQUEADOR DA POMC: a pró-opiomelanocortina é um pre–
cursor do hormônio alfa-MSH, que ativa a melanogênese. Ex.:
Neurolight.
• PROTETOR SOLAR: mais eficiente bloqueador da radiação UV na
pele.
Peelings
O peeling químico está entre os procedimentos cosméticos mais comuns
na prática médica e é usado há décadas devido a ser um procedimen–
to simples e de baixo custo. É definida como a aplicação de agentes quí–
micos, de força variável na pele, que resulta na destruição controlada
da epiderme e da derme (CARRER et al., 2008). A esfoliação induzida é
seguida pela regeneração dérmica e epidérmica do epitélio adjacente e
anexos cutâneos, o que resulta em melhora da textura superficial e da
aparência da pele (BONFIM, 2022).
Os peelings químicos são classificados, com base na profundidade de
penetração, em peelings superficiais (epiderme – derme papilar), médios
(papilar à derme reticular superior) e profundos (derme reticular me–
diana). Nos distúrbios de pigmentação, normalmente utilizamos os pee–
lings superficiais e os médios.
O ácido glicólico (AG) é utilizado como peeling superficial ou de média
profundidade devido a ser um agente esfoliativo que causa epidermólise
com descamação da pele por redução da adesão de corneócitos e obstru–
ção de queratinócitos no estrato granuloso. Semelhante a outros α-hidro–
xiácidos, leva a um espessamento da epiderme e da derme, com aumento
da síntese de colágeno e mucopolissacarídeo, e dispersão de melanina.
Os peelings de GA estão disponíveis em concentrações de 20 a
70%. A profundidade de penetração e a intensidade dos peelings de
GA aumentam com concentrações e tempo de exposição. Esse agen–
te deve ser neutralizado com uma solução alcalina, com bicarbona–
to de sódio ou solução salina normal, para interromper seus efeitos
esfoliativos.
O ácido láctico (LA) é utilizado sozinho ou em combinação com ou–
tros peelings. Seus efeitos de clareamento na pele se dão em função de di–
minuir a síntese de melanina ao inibir diretamente a enzima tirosinase.
A solução de Jessner (JS) é um agente de peeling superficial comu–
mente usado com outros peelings para aumentar sua penetração. Seus
mecanismos de ação são específicos para cada ingrediente, mas geral–
mente é proposta a quebra de pontes entre os queratinócitos.
O ácido kójico (KA) é um agente quelante de cobre, e suas proprie–
dades clareadoras estão na capacidade de inibir a enzima tirosinase.
Disponível em concentrações de 1 a 4% e geralmente usado em com–
binação com GA ou outros agentes clareadores (arbutina, aloesina, ex–
trato de soja, etc.) para aumentar a penetração e a eficácia. Pode ser
usado antes e após o peeling para prevenir e tratar a hiperpigmentação
pós-inflamatória.
O ácido tioglicólico (AT) em concentrações mais fortes, como 20%,
é usado na forma de peelings, que devem ser repetidos quinzenalmen–
te. O número de sessões necessárias varia geralmente entre 3 e 6 apli–
cações. A pele quase não descama, podendo permanecer avermelhadas
nas primeiras 12 horas. O uso de protetor solar é imprescindível após as
sessões.
Tecnologias
Os lasers e as fontes de luz podem ser um complemento eficaz à tera–
pia de escolha ou uma alternativa para falhas no tratamento com os
clareadores.
Vários lasers têm sido usados para tratar lesões pigmentares, sendo
os principais o rubi (694 nm) e o alexandrite (755 nm). Fototipos mais
altos são mais prováveis de desenvolverem reações adversas, especial–
mente PIH adicional após tratamento de laser. O LASER Nd: YAG com comprimento de onda de 1.064 nm é mais
efetivo para remoção de tatuagens de pigmentos ou tintas preta e azul.
Também pode ter sua frequência dobrada, emitindo um comprimento
de onda de 532 nm, o qual é mais absorvido pela melanina, sendo indi–
cado para o tratamento de lesões vasculares superficiais (ROH; CHUNG,
2009; AGNE, 2009; HORIBE, 2000; ALAM; GLADSTONE; TUNG, 2010;
CHAVANTES, 2009; GOLDBERG, 2007).
Segundo AGNE (2009) e CAMERON (2009), na laserterapia de bai–
xa potência, predominam importantes efeitos terapêuticos, os quais po–
dem ser observados clinicamente, em especial analgesia local, redução
de edema, ação anti-inflamatória e estimulação da cicatrização de feri–
das de difícil evolução. Os efeitos diretos, desencadeados pela absorção
da energia, limitam-se no ponto de aplicação, à profundidade de pene–
tração e ao tempo que dura a aplicação (NUNES et al., 2013).
Indicado para tratamento de alterações vasculares e pigmentares
superficiais, o laser Q-switch tem o comprimento de onda transmitido
pela água, embora penetre superficialmente na pele, sendo absorvido
numa distância menor que 0,1 mm na melanina e em 0,5 mm no sangue.
A luz intensa pulsada (LIP) se diferencia dos lasers em geral por
possuir uma luz policromática que emite um espectro amplo de com–
primento de onda, em geral na faixa de 400 a 1.200 nm e o fator de luz
incoerente. A energia, que é emitida em todas as direções, espalha-se.
A focalização e o direcionamento da luz são feitos por meio de superfí–
cies espelhadas colocadas atrás das lâmpadas. Dessa forma, a aplicação
é mais suave e de menor intensidade do que o laser (NUNO, 2009).
Os sistemas de LIP emitem pulsos simples, duplos ou triplos, com in–
tervalos variáveis, permitindo o resfriamento do tecido de 2 a 25 milis–
segundos de duração. Os comprimentos maiores de onda penetram mais
profundamente na pele, aumentando, assim, a destruição de vasos pro–
fundos, enquanto a duração de pulsos maiores aquece os vasos de maior
calibre mais lentamente, evitando o rompimento vascular (KEDE, SA–
BATOVICH, 2009; SAMPAIO; RIVITTI, 2000; ALAM; GLADSTONE; TUNG,
2010).
A tecnologia da LIP é utilizada de maneira eficaz para tratar uma
variedade de disfunções vasculares e pigmentadas, além de outras indicações.
Entretanto, uma das suas principais limitações, reside no tra–
tamento de pacientes com fototipos mais altos, sendo necessário que
o profissional determine a fluência de energia conforme a tabela de
Fitzpatrick.
A expressão light emitting diodes (LED) remete a diodos semicon–
dutores submetidos a uma corrente elétrica, que emitem a luz utilizada
para fototerapia, com comprimento de onda que varia de 405 nm (azul)
a 940 nm (infravermelho). A luz vermelha é mais apropriada para o tra–
tamento de tecidos superficiais, a uma profundidade de 5 a 10 mm, como
a pele e tecido subcutâneo. Os aplicadores que liberam luz azul são mais
adequados para o tratamento de tecido mais superficial ainda, como a
pele ou tecido mole exposto (JEDWAB, 2010; CAMERON, 2009).
Os emissores de LEDs produzem luz de baixa intensidade, que pode
aparentar ser de uma só cor, mas não são coerentes nem monocromá–
ticos. A luz emitida não é direcional e se espalha amplamente. Os LEDs
fornecem uma luz mais difusa, que é mais adequada para tratar áreas
maiores e mais superficiais, com maior faixa de frequência. São de baixa
potência individualmente (CAMERON, 2009; NUNO, 2009; KALIL, 2011).
Sua ação se dá pela estimulação direta e intracelular, especificamen–
te nas mitocôndrias, reorganizando as células, inibindo ações e estimu–
lando outros resultados no chamado efeito da fotobioestimulação ou fo–
tomodulação (JEDWAB, 2010). O LED azul tem efeito hidratante e pode
ser utilizado para tratamento envolvendo hiperpigmentação por altera–
ção vascular.
Tratamento oral
O tratamento das hipercromias ainda apresenta limitações e há algu–
mas evidências que sustentam a eficácia da terapia oral.
• Polypodium leucotomos: propriedades benéficas atribuídas à pre–
sença de vários compostos com propriedades antioxidantes e fo–
toprotetoras. Por via oral, P. leucotomos fornece algum grau de
proteção contra os efeitos nocivos da radiação ultravioleta, aju–
dando assim a minimizar os efeitos do fotoenvelhecimento da luz
solar, incluindo hiperpigmentação e alterações texturais.
• Ácido tranexâmico: é um medicamento antifibrinolítico prescri–
to para tratar sangramento e também é usado off-label para tra–
tar e/ou prevenir a HPI. É usado por via oral 500 mg por dia. É
contraindicado em pacientes com condições hipercoaguláveis,
insuficiência renal, distúrbios da visão, gravidez, amamentação,
ou em terapias hormonais. O mecanismo exato do TXA na redu–
ção da melanogênese é desconhecido.
• Hidroxitirosol: o hidroxitirosol (Oli-Ola®) tem propriedades an–
tioxidantes superiores às das vitaminas C e E. Apresenta efeitos
quimiopreventivos aos danos causados pela radiação UV. É co–
mercializado como peeling oral nas concentrações de 300 mg diá–
rios em terapias únicas ou em conjunto com outros agentes cla–
readores, com o intuito de diminuir a hiperpigmentação cutânea.
• Pinus pinaster (picnogenol): tem propriedades antioxidantes e
anti-inflamatórias e, portanto, elimina os radicais livres. A sua
atividade consiste na inibição da biossíntese da tirosinase, cau–
sando interferência na formação da melanina. Vem sendo utiliza–
do devido ao seu efeito inibitório na pigmentação, com o intuito
de melhorar a aparência da pele e agir na redução progressiva da
área e na intensidade das hipercromias. Estudos comprovam ser
mais potente que as vitaminas E e C, com capacidade de aumen–
tar o sistema antioxidante endógeno, sendo comercializado nas
concentrações de 75 a 100 mg.
• Extrato de semente de uva (proantocianidina): contém um po–
deroso antioxidante, e a sua ingestão oral, 67mg 3x ao dia, por 6
meses, foi considerada benéfica em pacientes com melasma, sen–
do necessários estudos adicionais sobre o benefício na HPI.
• Glutationa: é um composto produzido no corpo e atua como for–
te antioxidante. Tem atividade clareadora por meio de vários me–
canismos: mudança na produção de feomelanina sobre eumela–
nina; inibição da tirosinase; e extinção de ROS e radicais livres,
que influenciam a ativação da tirosinase. Em um estudo clínico,
50 mg de pastilha de glutationa mostrou aliviar ou reduzir mo–
deradamente a hiperpigmentação em 90% dos indivíduos (HAN–
DOG et al., 2016). Embora a glutationa seja frequentemente co–
mercializada como um tratamento seguro, faltam estudos sobre seu uso para clareamento da pele,
com a maioria dos estudos ten–
do limitações, incluindo pequenos tamanhos de amostra, curtas
durações de estudo, curtos períodos de acompanhamento e a fal–
ta de biodisponibilidade. Além disso, o uso IV tem sido associado
a várias complicações, incluindo síndrome de Stevens-Johnson,
dor abdominal, disfunção renal, toxicidade cerebral e disfunção
hepática.
• Arnica: dentre os medicamentos fitoterápicos e homeopáticos, a
arnica montana é um dos mais empregados, visto sua potente
atividade anti-inflamatória, sendo indicada, sobretudo, para re–
dução do edema e alívio da dor decorrente de trauma tecidual.
São também atribuídas as propriedades cicatrizante, antissép–
tica, antimicrobiana, fungicida, anti-histamínica, cardiotônica e
anticoagulante.
Tratamentos alternativos
Alguns outros tratamentos podem ser associados para otimizar a res–
posta aos tratamentos convencionais. Entre eles:
• Carboxiterapia: o mecanismo de ação da carboxiterapia se dá
de forma mecânica e farmacológica. O efeito mecânico ocorre
pelo trauma da entrada da agulha e do gás, que gera um pro–
cesso inflamatório, com a consequente migração de fibroblas–
tos para o local, iniciando a síntese de colágeno, reparação des–
se tecido, aumento da troca de oxigênio no local, melhorando
a irrigação e a nutrição celular (BORGES, 2010; ROH; CHUNG,
2009). São indicações da técnica de carboxiterapia, patologias
que se beneficiam com o aumento da circulação e oxigenação. A
carboxiterapia tem trazido bons resultados na maioria dos pa–
cientes com queixas de hipercromia. Em pacientes que não ob–
têm um mínimo de melhora até a terceira sessão, o tratamento
é suspenso. A aplicação é feita de forma a promover o desloca–
mento tecidual, com um fluxo de 80 ml/min a 150 ml/min e fre–
quência mensal das sessões.
• Fototerapia: modifica a atividade celular, utilizando uma fonte de
luz sem efeito térmico, laser e/ou LED, com o objetivo de melhorar as
alterações pigmentares, removendo os pigmentos, aumen–
tando a microcirculação e melhorando a eliminação de toxinas.
• Microcorrente: alternativa viável no tratamento da HP. Trata–
-se de um tipo de eletroestimulação. Os efeitos: revitalização
cutânea, aumento da síntese de ATP e da produção de colágeno,
clareamento da pele, estimulação da microcirculação cutânea,
resultando em uma melhor nutrição e oxigenação tecidual, mobi–
lização da linfa, melhorando a circulação local. Os resultados da
microcorrente são de caráter acumulativo.
• Plasma rico em plaquetas (PRP): o PRP é um composto autólo–
go, cuja concentração plaquetária é de 3 a 5 vezes maior que a
concentração plasmática normal. Além da alta concentração de
plaquetas, é rico em fatores de crescimento, que são secretados
pelas plaquetas e agem no processo de cicatrização. Segundo
MEHRYAN et al., em seus estudos, quando se trata da eficácia do
uso de PRP para melhora da HPO, tem-se um resultado significa–
tivo na homogeneidade da cor.
• Uso da hialuronidase: pode ajudar a tratar os hematomas nas fa–
ses gelatinosa (coagulação) e de consolidação, reduzindo, assim,
os riscos de complicações, o tempo de inatividade do paciente e o
surgimento das manchas pós-hematomas.
• Técnica de indução percutânea de colágeno: também conheci–
da como microagulhamento, pode ser incluída em nosso arse–
nal terapêutico no tratamento das hipercromias, principalmente
quando essa se mostrar resistente aos tratamentos convencio–
nais. O número de sessões com intervalo de 30 dias depende da
intensidade do HPI, não havendo limite para o número de inter–
venções. Além disso, cada intervenção oferece um ganho na re–
dução do pigmento e melhora na qualidade da pele, ainda mais se
associado ao drug delivery.
• Escleroterapia: o produto de longa duração induz a neocolagênese e a neovascula–
rização devido ao padrão inflamatório da reação tipo corpo es–
tranho. Em alguns pacientes, pode-se observar a formação de
pequenos vasinhos, as telangiectasias, que representam veias
menores que 1 milímetro de diâmetro que se desenvolvem logo
abaixo da pele e até mesmo da mancha, geralmente de coloração avermelhada ou arroxeada.
Apesar de não representarem nenhuma ameaça à saúde do indivíduo, são indesejadas tanto por
serem antiestéticas quanto por também estarem possivelmente associadas à própria mancha.
O objetivo é causar destruição do endotélio, de modo que oblitere a luz dos próprios vasos e, dessa
maneira, não passe mais sangue por ali. Com o tempo, o organis–
mo reconhece esse vaso como não funcionante e o absorve, fa–
zendo com que ele não seja mais visível.
Tratamentos promissores
A necessidade e a demanda por tratamentos mais novos, seguros e efi–
cazes para os mais diversos distúrbios de hiperpigmentação estão sem–
pre abrindo o caminho para que se explorem continuamente as opções
de tratamento. Vários compostos e combinações estão atualmente sen–
do testados e mostraram resultados promissores nas fases iniciais dos
ensaios clínicos e estão sendo considerados para avaliação posterior.
Nanopartículas lipídicas sólidas
Uma área que tem mostrado resultados promissores é o uso de veículos
alternativos para administração de medicamentos.
O uso de nanopartículas lipídicas sólidas pode aumentar a biodis–
ponibilidade e a estabilidade tópica dos medicamentos. Por exemplo,
a hidroquinona, preparada para nanopartículas lipídicas sólidas mos–
trou eficácia melhorada quando comparada à hidroquinona tópica pa–
drão. Além disso, outros veículos medicamentosos, como lipossomas e
microemulsões, também mostraram resultados encorajadores (GHAN–
BARZADEH et al., 2015; ÜSTÜNDAĞ OKUR et al., 2019; BANIHASHEMI
et al., 2015)
As nanopartículas lipídicas sólidas foram exploradas como escolhas
atraentes para entrega tópica, pois formam uma camada oclusiva na su–
perfície da pele, levando à hidratação do estrato córneo e a aumento da
penetração da droga. Além disso, elas oferecem muitas vantagens, como
alta carga de medicamentos, maior estabilidade e biodisponibilidade.
Lipossomas
São vesículas microscópicas e esféricas compostas por uma bicamada
concêntrica fosfolipídio e colesterol e podem incorporar a droga hidrofóbica e hidrofílica.
Eles podem se fundir facilmente com a membrana
celular e alterar a fluidez da membrana para fornecer efetivamente a
droga e aumentar a penetração do estrato córneo. O microagulhamento
foi sugerido para aumentar os efeitos ativos sobre a forma lipossomal.
Orais
• Pentoxifilina 1.200 mg/dia por 8 semanas: é um agente hemor–
reológico que promove a perfusão da microcirculação pela me–
lhora da fluidez sanguínea e pelo desenvolvimento dos efeitos
antitrombóticos.
• Ácido ascórbico 1.000 mg/dia por um período de 8 meses: é um
eliminador de radicais antioxidantes e essencial para a síntese de
colágeno.
• Mistura de agentes venoativos com flavonoides orais: Diosmin
450 mg, Hesperidina 50 mg e extrato de Euphorbia próstata 100
mg por dia durante 2 semanas. Diminui a permeabilidade capilar,
inibe a produção de radicais livres de oxigênio e a peroxidação li–
pídica, diminui a síntese de prostaglandinas e tromboxano, e di–
minui a ativação endotelial e a viscosidade do sanguínea.
• Dobesilato de cálcio 500 mg por dia por 2 semanas: inibição da
síntese de prostaglandinas e tromboxanos, relaxamento vascu–
lar devido à produção de óxido nitroso, redução da viscosidade
do sangue e regulamentação negativa da expressão de VEGF.
• Colchicina 0,5 mg por 8 semanas: função imunomoduladora devi–
do ao bloqueio da quimiotaxia de células T.
LACTOFERRINA LIPOSSOMADA
A lactoferrina (LF) é uma glicoproteína de ligação ao ferro com proprie–
dades anti-inflamatórias, antivirais, antibacterianas, antifúngicas, an–
tiparasitárias e imunomoduladoras. Tem sido investigada para tratar
vários distúrbios. Apresenta dois lóbulos altamente homólogos, com ca–
pacidade de ligação de ferro estável e reversível. Sendo assim, possui
propriedades quelantes não só dos íons de ferro, mas também de cobre
e zinco, sendo utilizado em situações de discromias dermoepidérmicas.
PREVENÇÃO
Baseado em nossa prática clínica, listo algumas sugestões para preven–
ção das manchas a partir do controle do hematoma que surge após o
procedimento.
1. Conferir as medicações de uso regular do paciente: como pon–
tuado anteriormente, algumas medicações podem aumentar o
tempo de sangramento ou interferir na produção de melanina.
2. Controle do trauma da subincisão: ser o mais preciso no corte
do septo de fibrose reduz muito o trauma adjacente e, conse–
quentemente, o hematoma.
3. Idealmente comprimir a região em sangramento por 5 a 10 mi–
nutos: isso irá reduzir o tempo de sangramento e consequente–
mente o hematoma.
4. Compressas de gelo – com cuidado: o gelo no pós-procedimento
imediato e nos primeiros dias tem ação analgésica, além de di–
minuir o edema e a formação de hematomas.
5. Lavagem através do orifício com SF gelado: mesmo princípio do
uso do gelo.
6. Curativo compressivo – micropore/tape; mantê-lo por 2-3 dias:
favorece a reorganização do tecido cicatricial formado duran–
te o processo de reparação. Também acelera a reabsorção das
áreas equimóticas e minimiza o acúmulo de líquido.
7. Prescrição de ácido tranexâmico 250 mg – 2 cp. ao dia por 5-7
dias: em um estudo com ácido tranexâmico via oral, foi usado
off-label para tratar e/ou prevenir PIH com sucesso em aproxi–
madamente 82 pacientes de alto risco após lesões ou antes de
procedimentos que rompem a epiderme. Pode-se utilizar o tra–
tamento com TXA para todos os pacientes em risco profilati–
camente antes de serem submetidos a microagulhamento, crio–
terapia, criolipólise, peelings químicos e tratamentos a laser.
Entretanto, é contraindicado em pacientes com condições hi–
percoaguláveis, insuficiência renal, distúrbios da visão, gravi–
dez, amamentação, ou em terapias hormonais.
8. Uso da bermuda por pelo menos 7 dias, sendo o ideal por 30
dias: ajuda a otimizar o tratamento, pois a força compressiva gerada contribuirá para os benefícios da reabsorção equimótica e
para minimizar o acúmulo de líquidos.
9. Retoque com mais de 45 dias de intervalo: ao estender o retor–
no, a cicatrização da pele tratada estará completa e o risco da
hiperpigmentação também é reduzido por não abordar uma
pele ainda em processo inflamatório/cicatricial.
10. Se for possível e viável, orientar o uso precoce de fórmula trípli–
ce (tretinoina, corticoide e hidroquinona) ou de ácido glicólico
em pacientes que têm a tendência a hiperpigmentar.
11. Evitar a exposição solar até a melhora das manchas e o uso de
fotoprotetor.
CONSIDERAÇÕES
A hiperpigmentação pós-Goldincision® é um desafio por ainda não exis–
tir um tratamento definitivo e rápido. É uma alteração que pode afetar
qualquer fototipo e que preocupa as pacientes que desejam uma solução
e tratamento eficaz do problema.
Por tratar-se de uma discromia multifatorial, vários despigmentan–
tes são usados no intuito de combater essa alteração, assim como a as–
sociação com outros tratamentos para uma solução mais rápida e efeti–
va do problema.
Oriento para que, sempre que possível, se planeje o tratamento le–
vando em consideração todos os fatores que podem ser controlados, a
fim de se evitarem as hipercromias.
