INFLUÊNCIA DOS HORMÔNIOS NA CELULITE: COM ÊNFASE NA ADIPONECTINA

Conteúdo extraído do livro “Vitória Contra a Celulite” do Dr Roberto Chacur, Ed. AGE, 2023.
Dra. Gabriela Camargo
Dr. Roberto Chacur
INTRODUÇÃO
A celulite – conhecida também como lipodistrofia ginoide e fibro-edema geloide – é considerada um distúrbio estrutural, inflamatório e bioquímico do tecido subcutâneo, que leva a alterações significativas na aparência da pele. Isso se dá mediante a inflamação crônica vascular e de baixo grau de perturbação da circulação microvascular e linfática do tecido adiposo subcutâneo (ATAMOROS et al., 2018).
Quanto à etiologia, há um fator genético-constitucional influenciado por alterações hormonais, hábitos alimentares e sedentários (RIVITTI, 2018). Já em relação à patogênese da celulite, fatores inflamatórios têm sido associados e a inflamação crônica pode desempenhar importante papel no desenvolvimento de septos fibrosos. Na mulher, o septo fibroso é fino, com projeção perpendicular; já no homem, esse septo é mais grosso, com projeção oblíqua. Aparentemente, essas características histológicas favorecem o sentido de expansão do tecido gorduroso quando aumentado, sendo, na mulher, em direção à superfície e no homem, em direção à profundidade. Na mulher, o tecido se apresenta mais espesso; o tecido conectivo é mais frouxo, produzindo maiores saliências; e as células de gordura são maiores. A predominância da celulite no público feminino pode ser explicada pela diferença da organização do tecido adiposo entre os sexos (DAVID et al., 2011; BORGES; SCORZA, 2016; FRIEDMANN; VICK; MISHRA, 2017).
Podem desempenhar também importante papel na patogênese da celulite as significativas diminuições na expressão subcutânea da adiponectina (APN) – hormônio derivado de adipócitos com funções anti-inflamatória, antifibrótica e vasodilatadora. A adiponectina é uma glicoproteína expressa quase que exclusivamente no tecido adiposo (FRIEDMANN; VICK; MISHRA, 2017).
Ver Capítulos
CAPÍTULO 2 – CLASSIFICAÇÃO DA CELULITE
CAPÍTULO 5 – MODELAMENTO DE GLÚTEOS
CAPÍTULO 6 – TRATAMENTOS INJETÁVEIS PARA CELULITE
CAPÍTULO 7 – LASER-LIPO: TECNOLOGIA INVASIVA
CAPÍTULO 8 – OUTROS TRATAMENTOS PARA CELULITE
CAPÍTULO 9 – EFEITOS BIOESTIMULADORES
CAPÍTULO 10 – INFLUÊNCIA DOS HORMÔNIOS
CAPÍTULO 11 – GOLDINCISION®: UMA ABORDAGEM MULTIFATORIAL NO TRATAMENTO DA CELULITE
CAPÍTULO 12 – MANCHAS PÓS-GOLDINCISION ®
CAPÍTULO 13 – EFEITOS ADVERSOS E INTERCORRÊNCIAS NA GOLDINCISION®
Com a colaboração de colegas médicos experientes, o Dr. Roberto Chacur reúne neste livro uma abordagem em torno do tema que vai desde a gênese da celulite, o método próprio de avaliar e classificar, as doenças associadas e a modulação hormonal até os tratamentos existentes, o que realmente funciona e por qual motivo o método GOLDINCISION é considerado o padrão ouro.
CELULITE
A lipodistrofia ginoide ou ginecoide, cujo termo tem origem no grego
gynec-oid, conhecida também como fibroedema geloide e celulite, é um
distúrbio do tecido adiposo mais comum em mulheres, principalmente
após a adolescência. Ela é caracterizada por ser um processo não infla–
matório, que leva à ocorrência de retração irregular da superfície cutâ–
nea; acúmulo de gordura (tecido adiposo); ondulações na pele (aspecto
de casca de laranja); fibras de colágeno danificadas (comprometimento
da matriz dérmica); comprometimento da microcirculação (retenção de
líquidos); e nodosidade, podendo ser até dolorosas à palpação (Figura
10.1) (RIVITTI, 2018).
Há muitas teorias sobre a fisiopatologia da celulite, pelo fato de esta
ser complexa, necessitando de muitas pesquisas para elucidá-la. Esse
distúrbio provavelmente é multifatorial e tem como causas uma falha da
microcirculação; alterações anatômicas; redução na produção do hor–
mônio adiponectina pela célula subcutânea da pele; alterações no tecido
conjuntivo dérmico; polimorfismo genético; e processos inflamatórios
(SCHONVVETTER et al., 2014; TOKARSKA et al., 2018).
Múltiplos fatores também estão envolvidos na etiologia da celulite,
incluindo os de origem étnica, de gênero, genética, biotipo corporal, distribuição
do tecido adiposo e receptores envolvidos, sendo considerado
como principal desencadeante o hiperestrogenismo (MACHADO et al.,
2009).
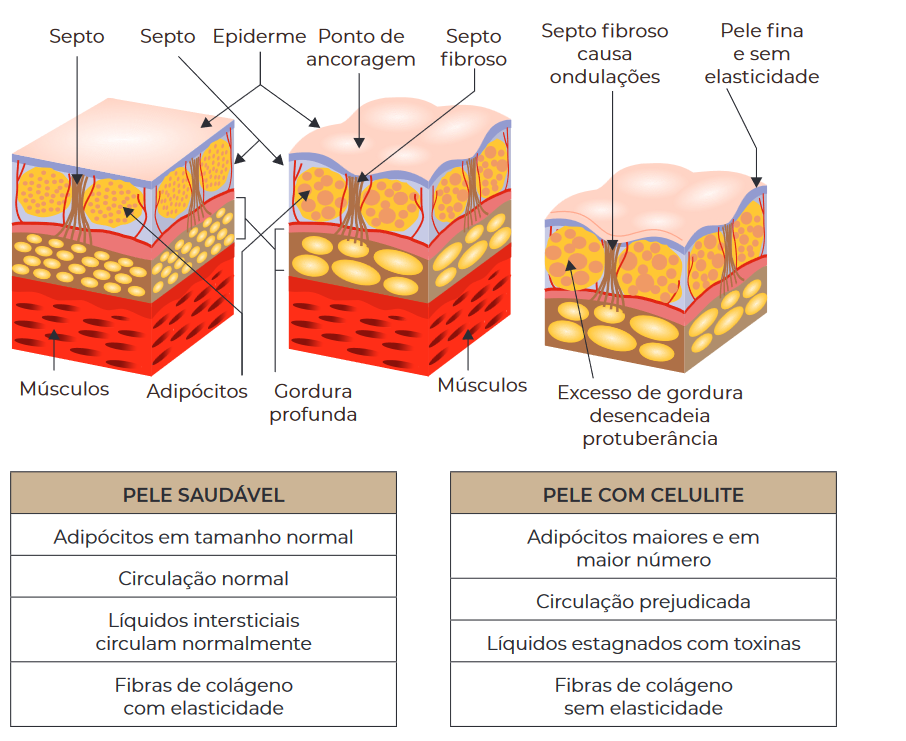
Pele saudável e pele com celulite com aumento do volume dos adipócitos e incremento dos arranjos de fibra de colágeno. Fonte: acervo do autor
O tecido adiposo libera uma adipocina benéfica, com ação anti-infla–
matória – adiponectina –, com capacidade de sintetizar e secretar a lep–
tina, responsável pela sensação de saciedade do nosso organismo (KOK–
KINOFTA et al., 2012).
A adiponectina leva também à melhora da sensibilidade à insulina,
suprimindo o efeito do fator de necrose tumoral alfa (TNF-α) e interleu–
cina 6 (IL-6) e interferon γ (INF- γ), atuando na proteção de doenças me–
tabólicas e cardiovasculares, que podem levar à ocorrência de celulite
(COIMBRA et al., 2014).
Na maioria dos casos, a avaliação da celulite é realizada com exame
físico, com o paciente em pé e os músculos relaxados, para que as lesões
deprimidas e elevadas sejam identificadas mais facilmente, independen–
temente do teste de pinça ou contração muscular (HEXSEL et al., 2015).
A celulite pode ser classificada em graus de 0 a III, com base em cri–
térios clínicos – indo desde a completa ausência de celulite até seu grau
mais grave (Quadro 10.1).
A classificação do Quadro 10.1, apesar de prática, não abrange todos
os aspectos morfológicos importantes da celulite. Nesse sentido, Hexsel
et al. (2009) e Hexsel et al. (2010) publicaram a Cellulite Severity Scale
(escala de gravidade da celulite), conforme o Quadro 10.2, com base em
cinco aspectos clínicos e morfológicos importantes da celulite: A) núme–
ro de lesões deprimidas em evidência; B) profundidade das depressões;
C) aspecto morfológico das alterações da superfície da pele; D) grau de
flacidez ou flacidez da pele; E) grau de celulite. Cada um desses itens
é classificado de zero a três; a soma total das pontuações deles indica
o grau de celulite em leve, moderada ou grave, conforme nos mostra a
Quadro 10.2.
Alguns estudos têm utilizado a escala de gravidade da celulite na
avaliação da melhora do quadro. Isso ocorre porque essa escala é consi–
derada objetiva e confiável na avaliação de resultados de ensaios clíni–
cos (HEXSEL et al., 2011; HEXSEL et al., 2013; HEXSEL et al., 2015).
Independentemente do grau da celulite, a população feminina é ex–
tremamente afetada, com incidência maior entre as faixas etárias de 15 e 45 anos –
fase reprodutiva. Essa condição atinge em média 95% das
mulheres pós-púberes, de todas as raças, com maior prevalência nas
caucasianas (AFONSO et al., 2010; CUNHA; CUNHA; MACHADO, 2015).
Comumente, as regiões mais afetadas pela celulite são: coxas, re–
gião glútea e abdome e, excepcionalmente, mamas, tórax e braços. As
regiões mais predispostas ao aumento do microedema nas camadas
de gordura subcutânea são as coxas e as nádegas, por conta da circu–
lação vascular baixa, que promove anormalidades na pele (ATAMOROS
et al., 2018).

Classificação da celulite com base em critérios clínicos. Fonte: HEXSEL et al. (2015)

Escala de gravidade da celulite. Fonte: HEXSEL et al. (2015)
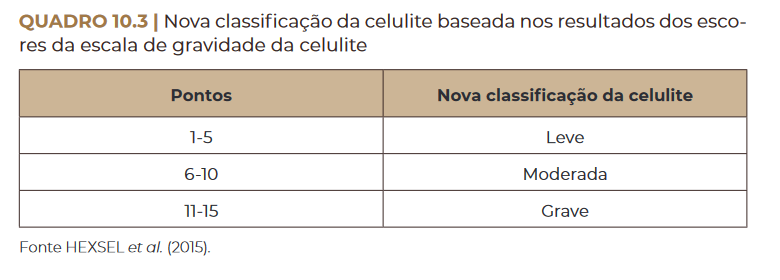
Nova classificação da celulite baseada nos resultados dos escores da escala de gravidade da celulite. Fonte HEXSEL et al. (2015)
PREENCHIMENTOS DÉRMICOS PARTICULADOS
Sculptra®
O ácido poli-L-láctico (PLLA), um polímero sintético, biocompatível
e biodegradável, tem sido utilizado com segurança em muitas apli–
cações clínicas nas últimas décadas. O Sculptra® pode ser catego–
rizado como um preenchedor estimulador, pois estimula a síntese
e o depósito de tecido fibroso e de colágeno. Na maioria dos estu–
dos, o efeito do Sculptra® na síntese de colágeno foi investigado in
vivo e a maioria dos dados foram provenientes de relatórios clíni–
cos e histológicos. Há apenas um estudo relatando esse efeito in vi–
tro usando fibroblastos. Aqui, investigamos se o PLLA na forma de nanopartículas
pode fornecer o mesmo efeito na síntese de coláge–
no em fibroblastos, assim como o Sculptra®. Surpreendentemente,
descobrimos que não houve estímulo de colágeno apenas em fibro–
blastos; por outro lado, as coculturas de fibroblastos e macrófagos
mostraram estímulo de colágeno por nanopartículas de PLLA (RAY,
2009, (p.1-9).
O Sculptra® foi introduzido em 1999 e é distribuído hoje pela Galderma
Laboratories (Dallas, Texas). Como uma das primeiras empresas de en–
chimento, a Galderma surgiu com o slogan de “neocolagênese” em 2009
(LACOMBE, 2009), uma aquisição de um fato histológico que ocorre dia–
riamente no reparo de feridas. O Sculptra® pode ser descrito como um
estimulador de uma reação de corpo estranho e é apenas mais um volu–
mizador cujo efeito desaparece quando a última microesfera é absorvi–
da pelo organismo (LEMPERLE; MORHENN; CHARRIER, 2020).
O Sculptra® contém microesferas lentamente absorvíveis de áci–
do poli-L-láctico (150 mg/frasco) para serem suspensas em 5, 10 ou até
mesmo 18 ml de gel de carboximetilcelulose, para evitar a formação de
nódulos no tecido subcutâneo. As microesferas são envolvidas por ma–
crófagos (Figura 9.3) que logo se fundem com células gigantes (Figura
9.4) e começam a decair aos nove meses (Figura 9.5) sem sinal histoló–
gico de fibras colágenas. Nessa época, por exemplo, fibroblastos em im–
plantes de PMMA secretam fibras de colágeno para manter as microes–
feras de PMMA no lugar por toda a vida e formar um tecido conjuntivo
permanente, incluindo capilares.
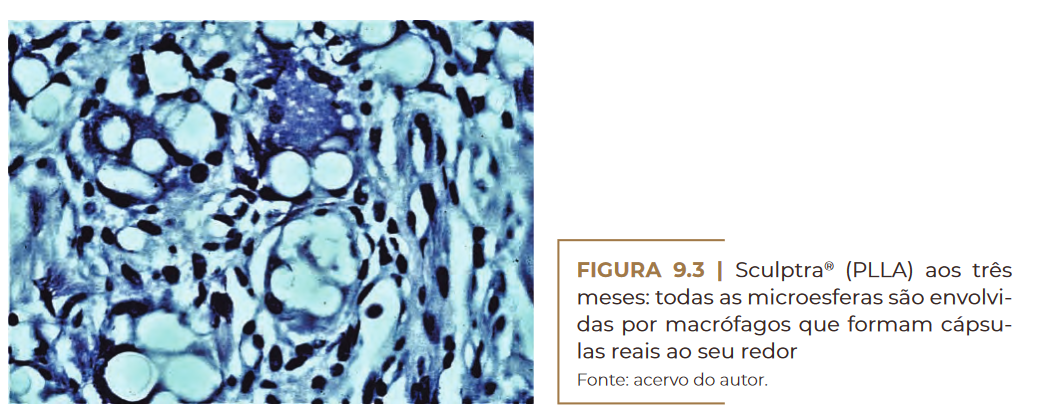
Sculptra® (PLLA) aos três meses. Fonte: acervo do autor.
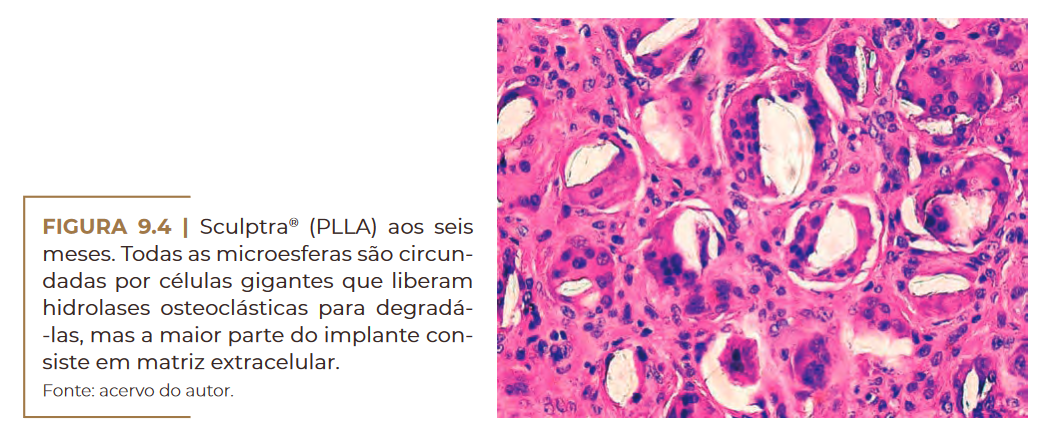
Sculptra® (PLLA) aos seis meses. Fonte: acervo do autor
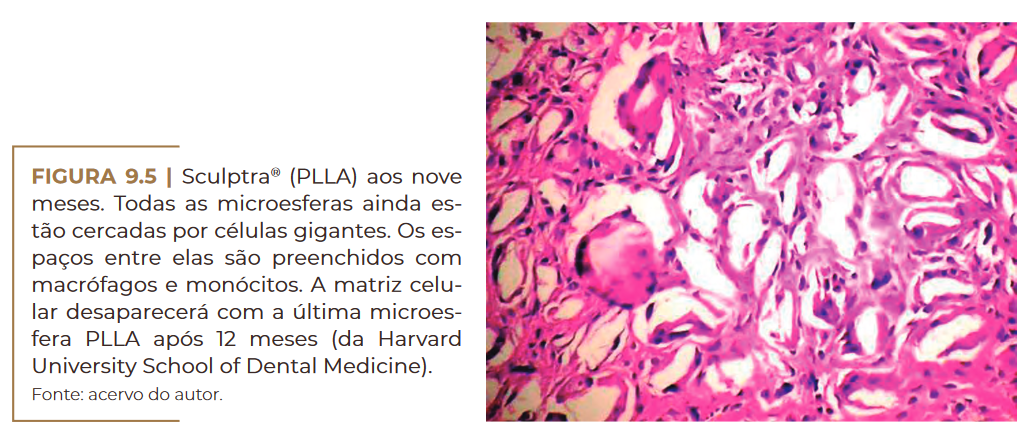
Sculptra® (PLLA) aos nove meses. Fonte: acervo do autor
Não foram encontrados dados na literatura científica ou na Inter–
net para provar a alegada neocolagênese após injeções de PLLA. Ao con–
trário, seu volume é povoado apenas por células gigantes, monócitos e
macrófagos, mas, obviamente, poucos fibroblastos e fibras colágenas
(Figura 9.4).
Radiesse®
Radiesse® é um biocompatível, biodegradável e reabsorvível preen–
chedor bioestimulador que pode estimular a produção endógena de
colágeno. É um produto único que proporciona tanto reposição de volume quanto
bioestimulação de colágeno como mecanismo primário
de ação. Após aproximadamente 9 ou até 12 meses, as partículas de
CaHA são degradadas em cálcio e fosfato e são eliminadas pelo siste–
ma renal. A correção imediata é gradualmente seguida pela formação
de um novo tecido por meio de neocolagênese, produção de elastina,
angiogênese e proliferação celular. O resultado é uma melhora estéti–
ca duradoura por ≥18 meses, com pele firme e elástica e aumento da
espessura da pele (ALMEIDA et al., 2019).
Radiesse® (Merz Aesthetics, Frankfurt, Alemanha) é o melhor in–
jetável biocompatível de todos, devido ao seu componente natural cál–
cio-hidroxila-apatita, molécula da qual os ossos e os dentes são feitos
(YUTSKOVSKAYA; KOGAN, 2017). As suas microesferas são suspensas
em carboximetilcelulose e causam os menores efeitos colaterais de to–
dos os materiais particulados injetados, especialmente os granulomas
de corpo estranho (LEMPERLE; MORHENN; CHARRIER, 2020).
Por outro lado, esse produto estimula uma reação de corpo estra–
nho leve (Figura 9.6) e é absorvido após nove meses como pequenos
fragmentos ósseos por hidrolases osteoclásticas, com envolvimento ce–
lular forte em uma reação de corpo estranho comum (Figura 9.7) (LEM–
PERLE, 2009).
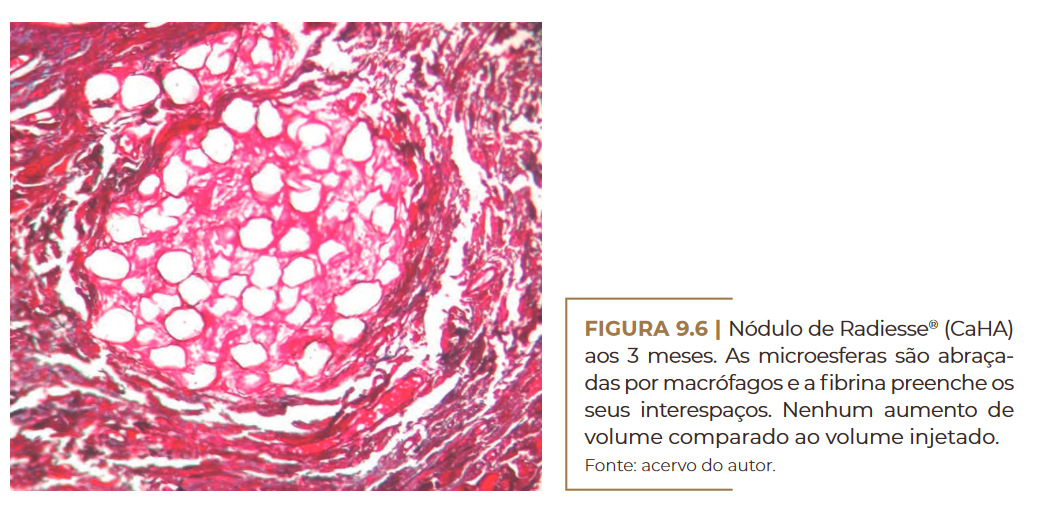
Nódulo de Radiesse® (CaHA) aos 3 meses. Fonte: acervo do autor
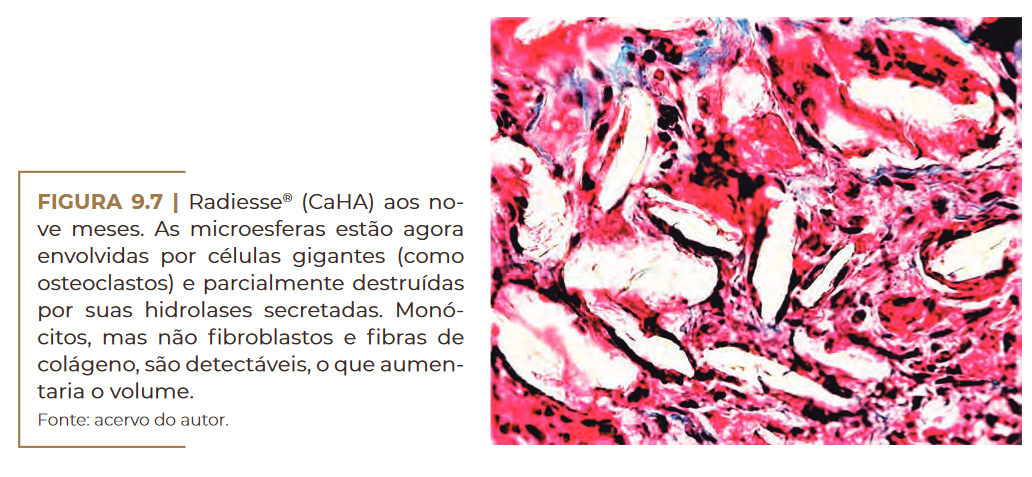
Radiesse® (CaHA) aos nove meses. Fonte: acervo do autor.
Logo após o Sculptra®, a comunidade Radiesse® adotou o pensamen–
to pleno de desejo de Galderma e da comunidade Sculptra®, além de tam–
bém reivindicar a bioestimulação e a neocolagênese como seus princi–
pais segredos (ALMEIDA et al., 2019; YUTSKOVSKAYA; KOGAN, 2017)
HORMÔNIOS NA CELULITE
Considerando que a celulite ocorre em quase 100% das mulheres pós–
-púberes, sendo rara sua ocorrência em homens sem deficiência andro–
gênica, os hormônios femininos certamente desempenham papel funda–
mental em sua etiopatogenia (AFONSO et al., 2010; HEXSEL et al., 2012;
JESUS et al., 2020).
Na mulher, os estrogênios são responsáveis por um número maior
de células de gordura armazenadas no tecido adiposo. O tecido conjun–
tivo encontra-se de forma radial ou perpendicular à superfície da pele,
levando à formação de compartimentos retangulares que facilitam a ex–
trusão das papilas na região derme-hipoderme. Essa região apresenta
também lóbulos maiores e septos paralelos. Já no homem, os septos fi–
brosos são menores e arranjados em planos oblíquos com pequenos ló–
bulos de gordura (Figura 10.2). Essa diferença explica o fato de apenas
2%, em média, dos homens desenvolverem celulite (CRUZ et al., 2015;
ARRUDA et al., 2016; MOURA; FEITOSA, 2019; TORTORA, 2019).
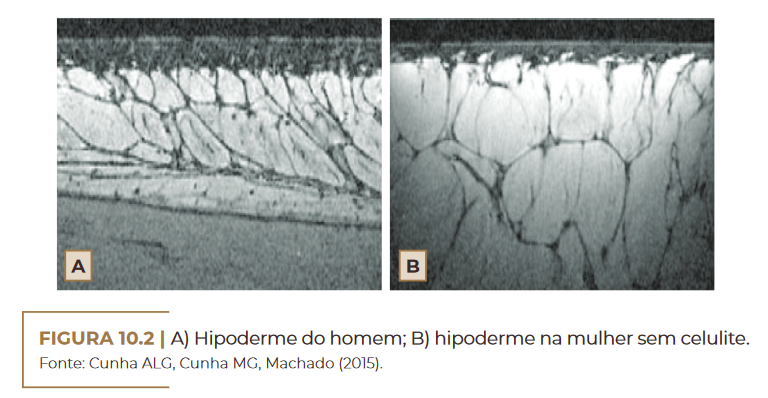
A) Hipoderme do homem; B) hipoderme na mulher sem celulite. Fonte: Cunha ALG, Cunha MG, Machado (2015)
Nos homens podem ocorrer casos de celulite se estes apresentarem
deficiência androgenética – hipogonadismo, síndrome de Klinefelter, es–
tados pós-castração e em pacientes que fizeram uso de terapia com es–
trógenos para câncer de próstata. O quadro pode piorar de acordo com
a severidade da deficiência (AFONSO et al., 2010).
O fato de a celulite afetar de maneira quase exclusiva a mulher, pe–
las características anatômicas da hipoderme e, principalmente, pela
influência hormonal tem merecido especial atenção (DAVID; PAULA;
SCHNEIDER, 2011).
O estrogênio, entre os hormônios envolvidos no processo da celuli–
te, é considerado o principal fator de desenvolvimento, além de respon–
sável pelo agravamento do quadro, agindo ao nível de: 1) substância
fundamental amorfa: leva à alteração do colágeno e das glicosamino–
glicanas, tendo como consequência o edema intersticial por conta do
acúmulo de água, que leva à fibroesclerose característica da celulite;
2) adipócitos: aumenta a resposta dos receptores α-antilipolíticos, es–
timulando a enzima responsável pela lipogênese (LPL); 3) microcircu–
lação: leva à diminuição do tônus venoso e à vasodilatação (CHORILLI
et al., 2007).
No mecanismo patológico da celulite, a matriz extracelular – forma–
da por fibras de colágeno e elastina, assim como por material intersti–
cial amorfo, pode sofrer modificações quando há desequilíbrio no seu
funcionamento, tanto por compressão dos seus elementos quanto por distensão,
o que levaria a uma resposta com intenção de equilibrar o
sistema. Essa matriz já pode ter sofrido alteração por alguns fatores ge–
néticos individuais, como idade, influência dos hormônios, entre outros
(DAVID et al., 2011).
As alterações hormonais podem levar a disfunções no metabo–
lismo que podem criar ou agravar a celulite. A título de exemplifica–
ção, no período da menopausa, a baixa produção de estrogênio é res–
ponsável pelo aumento da permeabilidade vascular e diminuição do
seu tônus, os quais comprometem a microcirculação, sendo, portan–
to, fatores predisponentes importantes ao desenvolvimento de celulite
(LESZKO, 2014).
Outros pontos que contribuem para a ocorrência da celulite são os
efeitos da deficiência de estrogênio no tecido conjuntivo da pele, que in–
cluem diminuição da produção e do conteúdo tópico das fibras de colá–
geno e elastina tipos I e III (LESZKO, 2014).
Denomina-se estrogênio um grupo de hormônios esteroides com
18 carbonos secretados principalmente pelos ovários, e pelas glându–
las adrenais, mas em menor quantidade. O estrogênio engloba três hor–
mônios esteroides estruturalmente semelhantes: 17β-estradiol (E2); es–
trona (E1) e estriol (E3). Destes, o 17β-estradiol é o principal esteroide
em humanos que possui propriedades estrogênicas (KENDALL; ESRON,
2002).
É clara a relação dos hormônios na mulher com a ocorrência da ce–
lulite, quando se considera que o estrogênio é uma causa significativa
no seu surgimento, em que diversos fatores podem explicar sua colabo–
ração na etiologia da celulite. A ocorrência desta se dá pela mudança do
tecido gorduroso, dos conectivos e dos vasos. Nos vasos, o estrogênio
pode aumentar ou diminuir a irrigação da região, comprometendo os te–
cidos, que se tornam mais fibrosados (MEYER et al., 2005; MENDONÇA;
RODRIGUES, 2011).
A diminuição de receptores de leptina no hipotálamo pode estar re–
lacionada à deficiência do estrogênio, que poderia levar à diminuição da
saciedade, maior ingestão, tendo como consequência ganho de massa
corporal. O estrogênio diminui o peso corporal, reduzindo o nível sérico
de leptina e inibindo a ingestão de alimentos (THOMPSON JÚNIOR; SII–
TERI, 1974; SIMPSON et al., 2002).
Além disso, esse hormônio também determina a quantidade e a dis–
posição da gordura corporal. No período menstrual, ocorrem variações
fisiológicas que podem levar ao edema, gerando um desequilíbrio no sis–
tema tegumentar. Esse desequilíbrio hormonal pode culminar na ocor–
rência da celulite ou agravá-la, principalmente na fase reprodutiva (EL–
LERVICK, 2021).
O eixo hipotálamo-adeno-hipófise regula a secreção dos hormônios
gonadais. A hipófise anterior secreta os hormônios folículo-estimulante
(FSH) e luteinizante (LH) em resposta ao hormônio liberador de gona–
dotrofinas (GnRH). A função do FSH na mulher é regular o crescimento
folicular e a crescente produção de estradiol pelas células da granulosa.
Já o LH é responsável pelo aumento da captação de colesterol, além de
estimular as células intersticiais da teca dos folículos ovarianos a secre–
tarem androstenediona e testosterona (androgênios). O FSH e, princi–
palmente, o LH, após a ovulação, atuam nas células luteinizadas da gra–
nulosa e da teca do corpo lúteo, levando ao aumento da produção de
estradiol e, em maior quantidade, de progesterona. Os hormônios gona–
dais, nessa fase, regulam a secreção de GnRH, FSH e LH por meio de um
mecanismo de retroalimentação negativa. A secreção de FSH é modula–
da negativamente por peptídeos produzidos no ovário, como ativina e
inibina (BULUN; ADASHI, 2003).
A retenção de fluidos pelas mulheres tem ligação com o estrogênio. O
corpo delas está programado para armazenar gordura para uso nos pe–
ríodos de gestação e amamentação; aparentemente, a atividade hormo–
nal, que em determinadas fases da vida feminina pode elevar excessiva–
mente os níveis de estrogênio, é um poderoso estimulante na formação
de celulite. Nas regiões mais afetadas, os sistemas linfático e circulató–
rio não são capazes de oxigenar e nutrir os tecidos, nem de drenar as to–
xinas. Partindo desse princípio, qualquer fator que propicie a retenção
de líquidos agrava os quadros de celulite. O tecido conjuntivo torna-se
disforme, evidenciando esse quadro, por estar mal oxigenado, subnutri–
do e sem elasticidade (ZIMMERMANN, 2014).
As alterações causadas por fibroblastos (principalmente o estróge–
no) na celulite levam à ocorrência de modificações estruturais nas gli–
cosaminoglicanas (GAGs) com hiperpolimerização, levando ao aumento
de seu poder hidrofílico e à pressão osmótica intersticial, o que gera o acúmulo
de líquido entre os adipócitos, tendo como consequência a de–
posição de colágeno na matriz intersticial. A falta de uniformidade na
deposição dessas fibras de colágeno promove uma esclerose irregular
de vários tamanhos, tanto nos vasos sanguíneos quanto nos adipócitos.
Com frequência, as mudanças no tamanho dos capilares levam à forma–
ção de microaneurismas, por estrangulamento, fazendo com que ocor–
ra o extravasamento de plasma para o interstício, juntamente com algu–
mas citocinas e linfócitos, reforçando essa desordem (SANT’ANA et al.,
2007).
A lipólise é um evento controlado por hormônios – glucagon, cateco–
laminas, paratormônio, hormônio melanócito estimulante, tirotropina e
adenocorticotropina –, além de adipocinas e citocinas (ZECHNER et al.,
2009). Já os adipócitos apresentam receptores β-adrenérgicos (agonis–
tas) e α2-adrenérgicos (antagonistas) associados à proteína G estimula–
tória e inibidora, respectivamente (RIBEIRO, 2010).
Quando se estimula o receptor β-adrenérgico, ocorre a ativação da
enzima de membrana adenilciclase, a qual transforma o ATP em AMPc;
a proteína-quinase inativa é responsável pela lipogênese. Na matriz in–
tersticial, o estrogênio estimula a produção dos fibroblastos e altera o
turnover das macromoléculas, levando à hiperpolimerização do ácido
hialurônico e à perda da elasticidade das fibras colágenas. Na microcir–
culação, aumenta-se a permeabilidade e diminui-se o tônus vascular, fa–
cilitando o edema e diminuindo o fluxo sanguíneo, o que também esti–
mula a lipogênese (KEDE; SABATOVICH, 2009).
No metabolismo do tecido adiposo há interferência dos sistemas
nervosos simpático e parassimpático. A ativação simpática estimula
a lipólise, sendo mediada por receptores β-adrenérgicos, que levam à
ação da enzima lipase hormônio-sensível (LHS). A ativação parassim–
pática tem efeitos anabólicos, como a captação de glicose e ácidos gra–
xos, estimulada pela insulina (FONSECA-ALANIZ et al., 2006; BORGES,
2010).
Também podem desempenhar importante papel no desenvolvimen–
to da celulite outros hormônios tais como: prolactina; hormônios da ti–
reoide; insulina; catecolaminas, incluindo noradrenalina e adrenalina;
além das citocinas (ELLERVICK, 2021).
FUNÇÃO E ESTRUTURA DA ADIPONECTINA E SUA INFLUÊNCIA NA CELULITE
A adiponectina é uma glicoproteína anti-inflamatória secretada de for–
ma abundante no tecido adiposo quase que de forma exclusiva, com ori–
gem nos adipócitos, sobretudo os subcutâneos. Apesar disso, pode ser
secretada também pelo endotélio, com função vasoprotetora. Sua con–
centração plasmática atua beneficiando a sensibilidade à insulina, atuan–
do como um anti-inflamatório. A concentração plasmática de adiponec–
tina em indivíduos obesos ou com síndrome metabólica apresenta-se de
forma reduzida (FRÜHBECK et al., 2017; KATSIKI, 2017).
A adiponectina tem um domínio exclusivo que se assemelha ao colá–
geno, com uma propriedade aderente à nectina, dando origem a seu nome.
Ela apresenta uma sequência primária de 244 aminoácidos, com um do–
mínio colágeno amino-terminal e um domínio globular carboxi-terminal,
que permitem formar multímeros compostos por isoformas oligoméricas
(MAEDA et al., 2020; MARTINEZ-HUENCHULLAN et al., 2020).
Quanto ao peso molecular da adiponectina, este é de 30 kDa. Essa
substância é codificada pelo gene ADIPOQ e está estruturada em 3 éxons
no cromossomo 3q27, que foi identificado como uma região portadora
de gene de susceptibilidade para o diabetes tipo 2 e síndrome metabó–
lica. Suas principais formas circulantes são em hexâmetro e multímero.
Os três complexos oligoméricos da adiponectina secretados na circula–
ção são de baixo (trímero – LMW), médio (hexâmetro – MMW) e alto
peso molecular (HMW). A depender do sexo, as concentrações plasmá–
ticas dessa forma podem sofrer variações, apresentando no homem 5,5
μg/mL e na mulher, 8,7 μg/mL (YADAV et al., 2013; TORRE-VILLALVAZO
et al., 2018; MAEDA et al., 2020).
Alguns autores consideram que a adiponectina se liga a três recep–
tores: AdipoR1, AdipoR2 e T-caderina (molécula de adesão celular que
possui uma âncora GPI com domínio transmembranar e intracelular).
Apesar da importância da T-caderina, ainda não são conhecidos em sua
totalidade os detalhes moleculares de interações desse receptor com a
adiponectina, uma vez que recebem menos atenção do que as interações
propostas com AdipoR1 e AdipoR2 (PASCOLUTTI et al., 2020).
A função da adiponectina é regular a oxidação de ácidos graxos, que
resulta em efeitos positivos na homeostase do metabolismo energético,
além de estimular as citocinas que agem em processos fisiológicos e fi–
siopatológicos, inibindo citocinas pró-inflamatórias, como o TNF-α e IL-
6. A adiponectina contém também propriedades de estimular IL-10, que
agem na proteção das células apoptose, induzida por citocinas inflama–
tórias (YANAI; YOSHIDA, 2019; DI ZAZZO et al., 2019).
A realização do mecanismo de indução e inibição de citocinas dá-se
pela sinalização de seus receptores AdipoR1 (este é altamente expresso
no músculo esquelético) e AdipoR2 (que fica mais restrito ao fígado). A
descoberta desses receptores ocorreu a partir de células transfectadas
com um DNA complementar (cDNA) do músculo esquelético humano, com
a utilização de um agente recombinante de forma globular da adiponecti–
na (FANG; JUDD, 2018; YANAI; YOSHIDA, 2019; MAEDA et al., 2020).
Emanuele et al. (2011) acreditam na hipótese de que a adiponec–
tina expressa no tecido adiposo subcutâneo (TAS) pode desempenhar
algum papel na patogênese da celulite. Nesse sentido compararam os
níveis de expressão gênica de adiponectina no TAS retirado da celuli–
te na região glútea com os níveis no TAS retirado da mesma região em
mulheres sem celulite. Foram medidos também os níveis plasmáticos
de adiponectina em mulheres com e sem celulite. Participaram do es–
tudo 30 mulheres, sendo 15 magras com celulite (IMC < 25 kg/m2) e
15 sem celulite pareadas por idade e IMC. Foi usada para avaliar a adi–
ponectina a reação em cadeia da polimerase com transcrição reversa
em tempo real (RT-PCR). A expressão do RNA mensageiro (mRNA) da
adiponectina no TAS da região glútea foi significativamente menor nas
áreas com celulite, em comparação com aquelas sem. No entanto, os ní–
veis plasmáticos de adiponectina não diferiram entre mulheres com e
sem a manisfetação desse quadro. Pode-se concluir que a expressão de
adiponectina está significativamente reduzida no TAS em áreas afeta–
das pela celulite.
CONCLUSÃO
dura subcutânea e da pele superficial sobrejacente. Já a adiponectina,
um hormônio derivado do adipócito produzido pela gordura subcutâ–
nea, apresenta efeitos protetores anti-inflamatórios e vasodilatadores
importantes, podendo desempenhar papel fundamental na patogênese
da celulite.
Acredita-se que a celulite, por ser multifatorial, pode ser causada,
entre outros fatores, pela redução da produção de adiponectina pelo te–
cido celular subcutâneo.
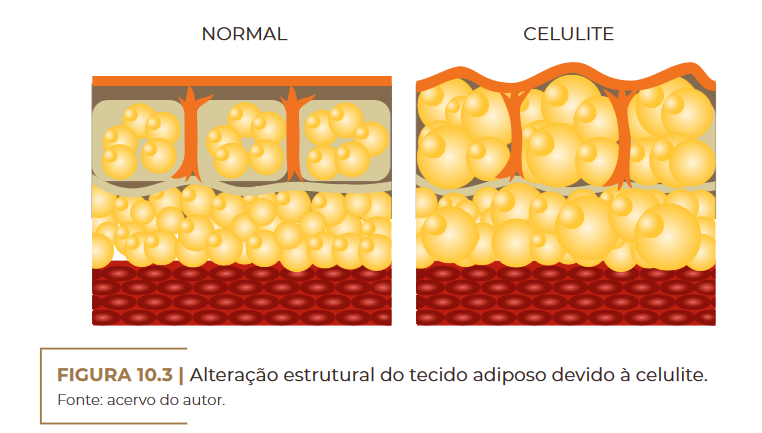
Alteração estrutural do tecido adiposo devido à celulite. Fonte: acervo do autor.
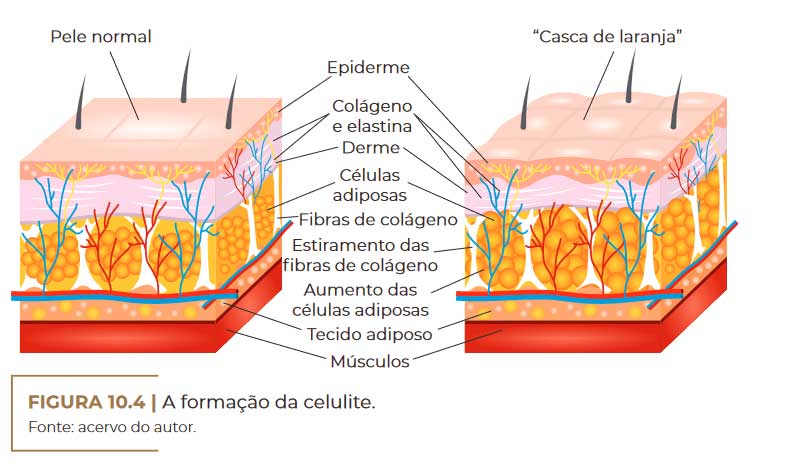
A formação da celulite. Fonte: acervo do autor
Comumente recebemos pacientes semelhantes, muitos em acom–
panhamento com nutrólogos e em uso de suplementos que auxiliam na
definição corporal, com perda de gordura. Existe uma satisfação geral
quanto ao corpo, coxas e abdome, entretanto, como a região glútea femi–
nina possui grande percentual dele sendo gordura, o seu tamanho aca–
ba diminuindo drasticamente quando da diminuição do percentual de
gordura (embora o aspecto de celulite possa melhorar), em nível maior
que ao ganho volumétrico do músculo glúteo máximo, médio e demais, e
isso acaba causando um insatisfação ainda maior dessa região, levando
muitos colegas nutrólogos a indicarem às pacientes a reposição volumé–
trica perdida com substâncias preenchedoras, visto que essas pacientes
também não teriam a possibilidade de realizar tratamentos com lipoes–
cultra, pela presença de pouca gordura para lipoenxertia. No caso aci–
ma, foi associado volumetria intramuscular, com um total de 200 ml de
Biossimetric® 30% em cada lado, em duas etapas, associado ao método
Goldincision®, melhorando a qualidade geral da pele, reestruturando o
colágeno, e implementando a circulação e o metabolismo local.
