Adendo: Análise microscópica do produto de longa duração

ANÁLISE MICROSCÓPICA
Resposta inflamatória após implante de microesferas de longa duração em camundongos BALB/c:
Análise hitopatológica do sítio de implante e orgãos à distância.
IPTSP/UFG – Instituto de Patologia Tropical e Saúde Pública, Departamento de Microbiologia, Imunologia, Parasitologia e Patologia da Universidade Federal de Goiás.
AUTORES DA PESQUISA
Eduardo Luiz da Costa, Vânia Beatriz Lopes Moura, Sarah Buzaim Lima,
Ruy de Souza Lino Junior, Anália Cirqueira Milhomem Instituto de Física
LABMIC – Laboratório de Microscopia
Considerações
Análise dos produtos realizada pelo LABMIC – Laboratório de Microscopia da UFG – Universidade Federal de Goiás (Instituto de Física) – Laboratório referenciado na região Centro-Oeste na análise de materiais.
Todas as normas técnicas de análise seguidas conforme a literatura.
Tatiane de Oliveira – Pós-Doutorada em Microscopia de Materiais
Laudo técnico assinado por:
Dra. Tatiane e Prof. Dr. Jesiel Freitas Carvalho – Comitê Gestor do LABMIC/UFG.
Foi utilizado MEV – Microscópio Eletrônico de Varredura, marca JEOL
Modelo JSM 6610. Para análise de imagens e determinação dos tamanhos das microesferas foi utilizado o programa Scandium, da Olympus Soft Imaging Solutions GmbH.
Ao longo dos anos, a versatilidade dos produtos se mostrou ampla, sendo utilizado desde 1945 na odontologia para a preparação de próteses dentárias (PURICELLI et al., 2011); seu uso foi refinado para o aumento e preenchimento de tecidos moles (LEMPERLE; GAÚTHIER-HAZA; LEMPERLE, 1995, 1998;
LEMPERLE et al., 2010a, 2010b), assim como para outros fins, como: reconstruções craniofaciais após trauma facial (ABDO FILHO et al., 2011), cimento ósseo para reconstrução ou correção de fraturas (HEINI; WALCHLI; BERLEMANN, 2000; NAGAE et al., 2016; ROTH et al., 2016; LIE et al., 2016); aumento peniano (CASAVANTES; LEMPERLE; MORALES, 2016); como espessante uretral para pacientes com incontinência urinária (LEMPERLE et al., 2011), dentre tantas outras possibilidades de uso.
Devido ao fato de uma rápida progressão do uso da bioplastia, progrediram também as primeiras descrições de reações adversas ao seu uso, como granulomas tardios (LEMPERLE; GAÚTHIER-HAZAN, 2009; LEMPERLE et al., 2009); formação de abscessos e reações alérgicas (STURM et al., 2011) – estudo que envolveu outros produtos; toxicidade sistêmica (MEDEIROS et al., 2014) – um estudo realizado por equipe da odontologia que sabidamente não utiliza o mesmo produto que a bioplastia e aplicava o produto intravascular visando a observar as reações sistêmicas, e as possíveis migrações ou fagocitose das microesferas menores (MORHENN; LEMPERLE; GALLO, 2002; LEMPERLE et al., 2004). Tais reações adversas estão intimamente relacionadas à má qualidade da matéria-prima utilizada; erro de procedimento de implantação, que inclui variação no tamanho da agulha, distribuição irregular e variação na profundidade do implante (LEMPERLE, 2006; FUNT & PAVICIC, 2013; JESUS et al., 2015).
Diversos fatores interferem no tipo e na intensidade da reação inflamatória do organismo frente ao preenchimento estético; dentre eles está o tamanho das microesferas do polímero, as quais devem medir entre 36-43 µm, uma vez que este parece ser o tamanho ideal para injeções dérmicas, impedindo a fagocitose e permitindo entrega e estabilização do material. Esse tamanho é aceito e sustentado por relatos da literatura que mostram que microesferas com diâmetro menor que 20µm desencadeiam resposta inflamatória do tipo granulomatosa, além de serem comprovadamente fagocitadas (MORHENN; LEMPERLE; GALLO, 2002), e maiores que 50µm não seriam implantados de forma eficiente (LEMPERLE et al., 2004; LEMPERLE, G; GAÚTHIER-HAZAN, 2009).
Segundo estudo realizado na Universidade Federal de Goiás (UFG) em 2016, as microesferas do produto de longa duração, muito utilizado por médicos no Brasil, obedecem à média de diâmetro ideal para sua melhor fixação, como é mostrado nas Figuras 1 e 2. A análise da dispersão de tamanhos de partículas revelou que a maioria das partículas (90,3%) estão no intervalo de tamanho entre 35 e 40 µm, apresentando diâmetro médio de 37,5 µm.
Vinculado ao tamanho das microesferas injetadas, outro fator que interfere na estabilidade do produto implantado, e consequentemente na reação inflamatória desencadeada, é a quantidade de deposição de colágeno ao redor das microesferas do polímero; esferas com diâmetro de 100 µm desencadeiam a produção de apenas 56% do tecido conjuntivo fibroso ao seu redor, enquanto esferas com diâmetro médio de 40 µm promovem o crescimento de cerca de 80% de fibras colágenas. Quanto maior a estabilidade do polímero, menor a probabilidade de dispersão e consequente resposta inflamatória exacerbada (LEMPERLE et al., 2010a, 2010b).
 Figura 1. Partículas de produto de longa duração e medidas de seus diâmetros.
Figura 1. Partículas de produto de longa duração e medidas de seus diâmetros.
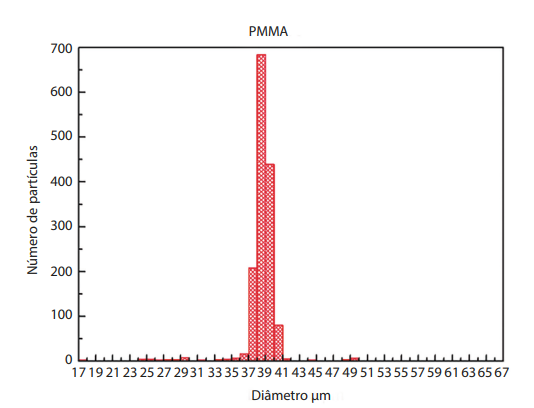 Figura 2. Histograma representativo da distribuição de tamanhos de partículas.
Figura 2. Histograma representativo da distribuição de tamanhos de partículas.
Por conta de todos esses fatores relacionados às microesferas e que interferem diretamente no resultado do preenchimento, algumas das marcas comercializadas mundialmente desse polímero, para seu uso em bioplastia, têm sua eficácia e segurança testadas e discutidas por muitos pesquisadores (LEMPERLE; MORHENN; CHARRIER, 2003; SOUSA et al., 2008; PIACQUADIO; SMITH; RUSELL, 2008; LEMPERLE et al., 2010a, 2010b;
COSTA et al., 2016). Lemperle, Morhenn e Charrier (2003) analisaram e compararam dez desses produtos (Zyplast®, Restylane®, Artecoll®, PMS 350®, New-Fill®, Reviderm Intra®, Dermalive®, Aquamid®, Evolution® e Radiance FM®), no que tange a sua biocompatibilidade e durabilidade; e constataram que todas as substâncias, reabsorvíveis ou não reabsorvíveis, mostraram-se clínica e histologicamente seguras; mesmo descrevendo reação inflamatória leve tardia, além de reação granulomatosa, os autores não atribuíram tais alterações celulares ao implante dos polímeros.
Outro estudo realizado por Sousa et al. (2008), em que implantaram produto de longa duração em camundongos BALB/c e analisaram a presença de resposta inflamatória frente à implantação, além de avaliar a deposição de colágeno; os autores concluíram que a implantação intramuscular de Newplastic® promoveu deposição de colágeno, mas não induziu inflamação crônica, o que demonstra a biocompatibilidade desse material para fins de bioplastia.
Piacquadio, Smith e Rusell (2008) objetivaram, em seu estudo, comparar 4 marcas de longa duração, disponíveis no mercado, a fim de determinar se havia variações significativas entre esses produtos, o que resultaria em diferentes perfis terapêuticos, dependendo da conduta do profissional, principalmente no que diz respeito à segurança. Os produtos analisados foram: Artefill® (ano de 2007, EUA); Artecoll® (ano de 2005, Canadá); Artecoll® (versão antiga 2001, União Europeia); Metacrill® (2006, Brasil); NewPlastic® (2006, Brasil). Os resultados apontaram diferenças significativas tanto entre a mesma marca, de versões diferentes, como entre marcas distintas; tais resultados demonstram que o uso desse polímero não pode ser generalizado, sendo necessário que o profissional que o manuseia tenha completa consciência da marca utilizada e das suas diferenças estruturais e reacionais em relação às outras.
Em 2010, LEMPERLE et al. avaliaram de forma detalhada a ação e consequência da implantação de ArteFill® (antigo Arteccoll e atual BellaFill) e descreveram o mecanismo de ação desse polímero, de que forma ele estimula a produção de colágeno com o auxílio do seu veículo (colágeno bovino), que devido sua viscosidade e características estruturais facilita a melhor distribuição das microesferas; relataram também as diferentes técnicas de injeção do produto que interferem diretamente na distribuição ideal do material, além da necessidade de padronização do volume implantado dependendo do local. Descreveram também as alterações faciais em que se indica a utilização de preenchimento para seu tratamento como dobras nasofaciais, linhas retas da testa, dentre outras; além das complicações ocasionadas por erros de técnica, como granulomas, reações alérgicas, vermelhidão e cicatriz hipertrófica.
Diante da ampla utilização da bioplastia pelo mundo e da visível necessidade de padronização de seu uso, profissionais brasileiros se reuniram em 2016 no 1.o Consenso Brasileiro de Implantes Infiltrativos (2016), quando foi amplamente discutida a utilização no Brasil nos últimos 20 anos, com o objetivo de esclarecer e uniformizar o emprego desse polímero em bioplastia. Segundo levantamento realizado nesse evento, mais de 87 mil pessoas no Brasil que fizeram preenchimento, sendo mais de 71 mil implantes faciais e mais de 12 mil implantes corporais, envolvendo tanto objetivos estéticos como reparativos. Dentre os pacientes que buscam a bioplastia para fins estéticos corporais, 88% deles querem alterar a morfologia, por meio da adequação volumétrica dos glúteos. Para que isso seja possível, costuma-se aplicar de 100 a 150 cc de volume em cada etapa do procedimento, de forma intramuscular.
Resultados preliminares de um estudo ainda em andamento na Universidade Federal de Goiás, onde pesquisadores implantaram intramuscularmente em camundongos BALB/c e avaliaram histopatologicamente as reações do organismo do animal frente ao polímero, mostram que, após 7 dias de implantação era visível observar intenso infiltrado inflamatório predominantemente polimorfonuclear, bem como de matriz extracelular provisória, características clássicas de inflamação aguda, o que evidencia a capacidade do procedimento de implantação e do próprio polímero de suscitar tal processo. Interessantemente, aos 30 dias após o procedimento de implantação, a região de instalação apresentava-se reorganizada, com remodelamento do tecido muscular bem como da matriz extracelular; as microesferas do polímero estavam rodeadas de colágeno depositado, mostrando-se mais bem alicerçada. Essas comprovações estão ilustradas na Figura 3.
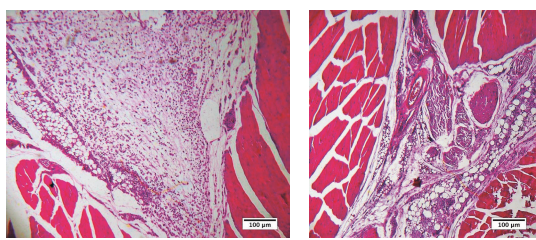
Figura 3. Fotomicrografias do músculo gastrocnêmico de camundongos BALB/c implantados com Linnea Safe® intramuscularmente, após 7 (A) ou 30 (B) dias da implantação. A – Intenso infiltrado inflamatório polimorfonuclear associado a matriz extracelular provisória ao redor das microesferas. B – Reorganização do tecido, com as microesferas contidas por depósito inicial de colágeno, infiltrado inflamatório moderado e pleomórfico. Coloração H&E. Realizado por IPTSP/UFG.[/caption]
Ver Capítulos
Introdução
Em busca da fonte da juventude
Primeira Parte: CONCEITOS DE BELEZA
Anatomia ósse da face
Anatomia da pele
Beleza e Atratividade
– Por que achamos alguém bonito?
– Sequência de Fibonacci
– Estética áurea
– Para pensar
Etiologia do envelhecimento
– Como nos tornamos senis?
– Telômeros e senescência
– Isto é surpreendente!
– Vida útil em discussão
– O equilíbrio da imunidade
O envelhecimento cutâneo
– Fisiopatologia
– Achados clínicos
– Medidas preventivas
– A importância do bom-senso médico no tratamento estético
Transtorno dismórfico corporal
– Etiologia
– TDC e procedimentos estéticos
O potencial de transformação dos fillers
– Condições ideais para um bom produto de preenchimento
– O que é o preenchimento
– Lifting X Ressurfacing
– Técnicas de volumetria
O que a ciência promete para o futuro?
Segunda parte: PREENCHEDORES MAIS USADOS
Não permanentes
Permanentes ou não absorvíveis
Características gerais
Ácido hialurônico
MD Codes
Ácido polilático
– Utilização dos fios de ácido polilático
Hidroxiapatita de cálcio
Hidrogel
Silicone líquido injetável
Outros tratamentos associados a preenchimento
– Toxina botulínica
– Laser CO2 fracionado
Adendo: Análise microscópica do produto de longa duração
Terceira parte: O PASSO A PASSO DA TRANSFORMAÇÃO
Uma plástica minimamente invasiva
O instrumental que se usa
O procedimento e a “mão” do médico
Tipos de anestesia
Perigos do procedimento com preenchedores em geral
Topografia facial e riscos do preenchimento
Complicações e como gerenciá-las
Quarta parte: PROCEDIMENTOS FACIAIS E CORPORAIS
Preenchimento facial
Preenchimento das maçãs do rosto
Preenchimento de rugas, sulcos faciais e cicatrizes
Rinomodelação com preenchimento
Preenchimento da mandíbula
Preenchimento labial
Preenchimento do mento
Preenchimento de pálpebras
Preenchimento peitoral
Preenchimento de glúteos
Preenchimento em lipodistrofia
Bioplastia genital
– Bioplastia e técnicas para aumento do pênis
– Bioplastia de saco escrotal
– Bioplastia de glande
– Bioplastia de vulva
– Bioplastia de clitóris
– Bioplastia de reconstrução após mudança de sexo
Poliomielite
Síndrome de Parry Romberg
Tratamento de celulite e irregularidades cutâneas
Goldincision – Tratamento com bioestimulação e descolamento
Quinta parte: ASPECTOS JURÍDICOS
A Anvisa e os produtos aprovados por ela
Direito e Medicina
A lei e o uso de implantes líquidos
O Código de Ética Médica
