OUTROS TRATAMENTOS ASSOCIADOS A PREENCHIMENTO – Laser CO2 fracionado

Conteúdo extraído do livro “Ciência e Arte do Preenchimento”, Ed. AGE, 2018.
Indicado para o rejuvenescimento de várias partes do corpo humano, o laser de dióxido de carbono (laser CO2) tem bons resultados na face, nas pálpebras, no pescoço, colo e mãos, bem como no tratamento de cicatrizes hipertróficas, cicatrizes de acne, traumáticas ou cirúrgicas, estrias, remoção de manchas superficiais e flacidez da pele. Especialmente empregado para eliminar celulite e linhas finas da face – ao redor da boca, dos olhos, das maçãs do rosto e da testa –, age aquecendo a água presente na derme até destruir o seu tecido. Penetrando até a segunda camada da pele, equipara-se a um peeling profundo, estimulando também a remodelação e contração do colágeno, o que resulta em menor flacidez.
Com o tempo, percebe-se melhora nas rugas e manchas da pele: ela fica mais viçosa, com poros menores, e sua textura melhora. As sessões de laser CO2 fracionado podem incluir, na consulta de revisão, aplicações de skinbooster, tratamento que permite uma hidratação das camadas mais profundas da pele com aplicação de ácido hialurônico, o que estimula a produção de colágeno e dá firmeza à pele.
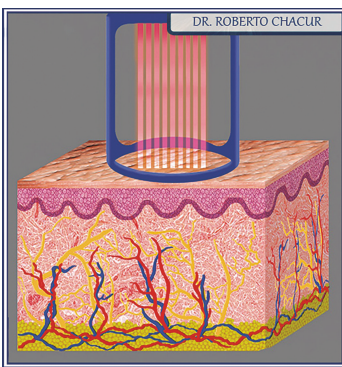
O laser CO2 fracionado é uma tecnologia que emite um feixe de luz com propriedade de ser atraído pelas moléculas de H2 O do corpo humano. Seu comprimento de onda é de 10.600 nanômetros e seu funcionamento se baseia na fototermólise seletiva: as células atingidas são vaporizadas a uma temperatura de 100° durante alguns microssegundos e, com isso, o laser CO2 fracionado remove entre 25 e 50 micrômeros de tecido em cada passada ou conforme regulagem
predeterminada.
Ao vaporizar as moléculas à semelhança de um chuveiro, ele estimula a cicatrização da área tratada, bem como a produção de colágeno, alcançando microporções da pele e deixando intactas outras tantas. É essa pele não afetada que vai facilitar a cicatrização das colunas de tecido atingidas pelo laser. As pequenas pontas de pele poupada permitem a reestruturação da epiderme de maneira mais rápida e possibilitam ao paciente retornar às suas atividades normais mais rapidamente.
Com isso, obtém-se uma diminuição das cicatrizes traumáticas e cirúrgicas, das manchas e das estrias. Bastam duas ou três aplicações para nivelar rugas e cicatrizes com medidas que chegam a um milímetro ou mais de profundidade.
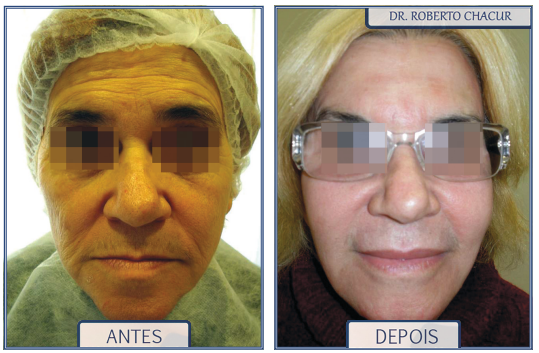
Todo esse processo promove o efeito de rejuvenescimento da pele, um procedimento excelente a ser realizado conjuntamente com os preenchedores em geral. Costumo realizar o laser CO2 fracionado e os preenchimentos em um mesmo momento (primeiro os preenchimentos e depois laser).
Idealizado pelo engenheiro indiano Kumar Patel em 1963, o laser de CO2 foi pioneiro no uso de gás. Ainda hoje é usado em larga escala na indústria, para cortar e soldar e, na medicina, como bisturi cirúrgico. O laser emite raios com comprimento de onda tal que são significativamente absorvidos pela água tecidual. É ela que determina seu grau de penetração na pele, e não a melanina ou a hemoglobina. A luz do laser de CO2 penetra cerca de 20 a 30 µ no tecido com uma duração de pulso inferior a um milissegundo.
Rejuvenescimento facial com lipoestimulação, projeção malar, mento, sulcos e laser CO2 .
Seu mecanismo de ação é a produção de calor. De modo geral, pequenas elevações de temperatura desencadeiam uma bioestimulação tecidual. Temperaturas entre 600 e 850ºC, por sua vez, provocam coagulação. Acima de 850ºC, elas resultam em carbonização e ao beirar os 1.000ºC, levam à vaporização.
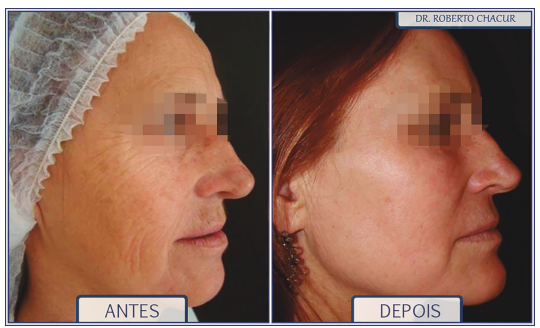
Preenchimento mandibular, malar, lipoestimulação com produto de longa duração, laser CO2 fracionado e toxina botulínica associados.
No caso do laser de CO2, a vaporização ocorre quando o raio entra em contato com a pele. Em consequência, resulta um aquecimento super-rápido, ebulição e vaporização da água, gerando a ablação (remoção), que provoca o resurfacing ablativo. Acredita-se que a transferência de calor responde pela desnaturação do colágeno, processo verificado em moléculas biológicas, principalmente proteínas, expostas a condições distintas daquelas em que foram produzidas, como as variações de temperatura. Em outras palavras, a proteína perde sua estrutura tridimensional e suas propriedades. Por outro lado, essa reação é exotérmica: libera um calor que se alastra para células adjacentes, causando um efeito térmico residual, que estimula a produção de colágeno. Durante o procedimento, a desnaturação do colágeno contribui para a contração do tecido visível a olho nu e melhora as rugas e a flacidez. Além disso, ela induz uma reação tecidual que gera neocolagênese durante cerca de seis meses após o procedimento. Em resumo, o rejuvenescimento da pele promovido pelo laser de CO2 se dá pela contração de colágeno, ablação da pele fotolesada, lesão térmica periférica e neocolagênese.
Na medicina, as primeiras versões do laser de dióxido de carbono foram empregadas para o tratamento de queilite actínica, nos lábios. Rapidamente, a técnica se estendeu para outras áreas da face, dando origem ao resurfacing ablativo, que se revelou extremamente bem-sucedido. No entanto, esse procedimento era muito doloroso e exigia cuidados pós-operatórios demorados e intensivos, e afastamento das atividades diárias. Além disso, os efeitos colaterais adversos – infecções, eritemas, hiper e hipopigmentações de longa duração, cicatrizes – eram frequentes. A partir de 1990, novos aparelhos foram desenvolvidos com base na teoria da fototermólise seletiva de Rox Anderson e uma nova gama de equipamentos com pulsos curtos (ultrapulsados), altas energias e scanner foi lançada no mercado. A incidência de complicações diminuiu, mas o tratamento continuou doloroso, com longos períodos de recuperação.
A fototermólise fracionada foi criada em 2004 pelo professor de Dermatologia Dieter Manstein e pelo pesquisador em Fotomedicina Rox Anderson, na Universidade de Harvard. Objetivo: oferecer resultados tão bons quanto o resurfacing tradicional, sem as desvantagens conhecidas. A proposta consistia em atingir as camadas mais profundas da pele (dérmico) de forma pontual, isto é, em frações microscópicas. Essas microfrações coaguladas pelo laser levam o nome de Micro Thermal Zones (MTZs).
Entre essas MTZs há ilhotas de pele saudável, íntegra, que não é tratada e funciona como promotora da cicatrização. Com isso, obtém-se uma ação profunda do laser, sem atingir, todavia, extensas áreas. Assim sendo, o período de recuperação é mais rápido.
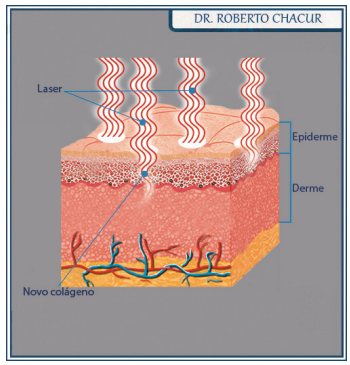
O primeiro equipamento a incorporar a técnica foi o Fraxel®. Em breve outros aparelhos surgiram, cada qual com suas especificidades. A técnica incorporou segurança com o tempo, abrindo espaço para procedimentos menos agressivos, ditos não ablativos. Diferentemente dos ablativos, eles não refazem a superfície da pele de modo tão efetivo e podem ser insuficientes para melhorar a elastose solar severa. Sua penetração na pele e estímulo à formação de colágeno também são menores.
O uso do laser ablativo fracionado foi disseminado em 2006 com o objetivo de oferecer uma técnica tão eficiente quanto o CO2 tradicional e tão segura
quanto o resurfacing fracionado não ablativo, no caso de remoção de rugas. O resurfacing ablativo fracionado provoca rupturas localizadas da epiderme, cercadas de pele intacta. A profundidade da lesão é proporcional à quantidade de energia empregada. Por ser fracionado, o resurfacing ablativo permite atingir camadas muito mais profundas (de até 1.500 µm) que o resurfacing ablativo não fracionado (10-300 µm). Embora mais segura, a técnica é menos eficiente para o tratamento de rugas faciais, fotoenvelhecimento e cicatrizes.
O laser de CO2 fracionado tem no rejuvenescimento cutâneo sua melhor indicação. É uma boa opção para o tratamento do envelhecimento facial, já que provoca a contração do colágeno. É indicado para pessoas que buscam rejuvenescimento da pele e o fim da flacidez. É excelente para rugas, pois consegue atingir diversas superfícies da pele, nivelando sua estrutura, e estimula a produção de colágeno nas áreas onde atua, dando-lhes uma aparência mais jovem.
Pode ser usado com uma ponteira cirúrgica em cirurgias estéticas, como na ninfoplastia e na blefaroplastia a laser. Tem igualmente uso terapêutico, para tratar ceratoses seborreicas e actínicas, verrugas virais, manchas, lesões pigmentadas, cicatrizes cirúrgicas, inclusive queloideanas, estrias atróficas e outras lesões de pele.
O fracionamento do laser também permite o tratamento de áreas extrafaciais, como a cervical, a região anterior do tórax, braços e pernas. Outras indicações são as cicatrizes de varicela, nevos, acrocórdons, rinofima, hiperplasias sebáceas, xantelasmas, siringomas, queilite actínica, angiofibromas, queloides e neurofibromas. Um outro estudo que apresentei no ASLMS (Congresso Americano de Laser) foi da associação do laser CO2 fracionado ao Q-Swished na remoção de tatuagem, sendo que o laser CO2 fracionado em um primeiro momento vaporiza a parte mais superficial da pele, que é possível deixar sem cicatriz removendo parte do pigmento e expondo o pigmento remanescente para que o Q-Swished possa atuar com mais propriedade.
O laser CO2 fracionado funciona por dermoabrasão em profundidade rigorosamente controlada, o que faz dele um tratamento muito seguro para o resurfacing ablativo.
A época do ano é decisiva, principalmente para pacientes de pele escura. Em consulta prévia, o profissional de saúde deve levantar a história clínica do seu paciente, submetendo-o a avaliação física e exames laboratoriais, se necessário. A aplicação do laser de CO2 fracionado é realizada em consultório e, após o procedimento, o paciente é liberado com um calmante para a pele. A profundidade e a intensidade do feixe de luz são ajustáveis de acordo com a regulagem do equipamento. Mesmo tendo sido definidos previamente, os parâmetros próprios a cada aparelho podem ser alterados de acordo com a sensação de dor do paciente. A pele deve ser perfeitamente limpa, desengordurada e seca, para que nenhum resquício de creme anestésico ou água atrapalhe a penetração do raio laser na pele. Também é importante que ela não esteja bronzeada. O uso de ácidos e cremes é permitido até dois dias antes do procedimento.
Em geral, o estímulo do laser no corpo é bem tolerado, bastando o uso de uma máscara anestésica tópica por até 1 horas antes do procedimento.
O tratamento com o laser CO2 fracionado tem um downtime (tempo de recuperação) de três a sete dias com aspecto visual muito ruim.
O número de sessões depende dos objetivos do paciente e varia entre duas e cinco. Cada sessão dura cerca de 20 a 60 minutos. Normalmente, as aplicações de laser são realizadas com intervalos de 30 a 60 dias, para permitir a completa regeneração da área tratada. Recomendo ao paceinte uma sessão anual como
manutenção e na minha percepção de 11 anos de uso do laser CO2 a pele desses pacientes está melhor a cada ano.
O laser CO2 é contraindicado na gravidez. Pacientes com doenças de pele, infecções e colagenoses ou que fazem uso de isotretinoína para tratamento da acne devem se abster. O laser CO2 fracionado também não deve ser usado em indivíduos de pele negra ou tendência a cicatrizes queloides, vitiligo, herpes, lúpus e outras doenças fotossensíveis. Além disso, pessoas que utilizam medicamentos fotossensibilizantes ou anticoagulantes orais devem optar por outras opções. Pacientes com problema de cicatrização hipercrômica (cicatrizes escuras) ou hipocrômicas (cicatrizes claras) devem ser cuidadosamente avaliados. É muito comum o paciente apresentar eritema e inchaço na pele após o uso do laser CO2 fracionado. O edema pode durar até 15 dias, e a vermelhidão, até 45 dias. Em alguns casos, usa-se a LIP (luz pulsada) e o LED (Light Emitting Diodes/ infravermelho) para obter uma melhor cicatrização e uma recuperação mais rápida, indicado somente após 30 dias de aplicação do CO2 fracionado, e se necessário.
Como a pele fica sensível com esse tipo de tratamento, há o risco de infecções. Além disso, o processo pode muitas vezes gerar cicatrizes, queloides e
manchas. Sendo o brasileiro resultante de miscigenação do europeu, do africano e do índio, sua pele, mesmo sendo branca, tem grande capacidade de
pigmentação, o que as torna mais comuns. Outra complicação possível é o surgimento de eritema.
A incidência dos efeitos colaterais, muito frequente no passado com o laser CO2 tradicional, diminuiu bastante com a nova tecnologia fracionada. Ainda assim, perduram casos de gravidade relativa:
EDEMA PÓS-OPERATÓRIO – Pode ser leve ou moderado. Na região periorbital, tem seu pico na manhã seguinte ao procedimento. No resto da face, manifesta-se com mais intensidade no segundo ou terceiro dias após o procedimento. Normalmente, não incomoda muito e pode ser tratado com sessões diárias de LED. Casos mais graves pedem corticoterapia oral (prednisona 40-60 mg/dia por 2 a 4 dias) ou intramuscular. Compressas geladas de chá de camomila, água termal em spray ou bolsas térmicas geladas também podem aliviar o desconforto.
ERITEMA – Muito comum após o uso do laser CO2 fracionado, sua manifestação é proporcional à profundidade do resurfacing e ao número de passadas. Na forma persistente, é extremamente raro e pode ser tratado com o Dye Laser ou a Luz Intensa Pulsada.
HIPOPIGMENTAÇÃO – Fenômeno tardio – Aparece cerca de seis meses após o tratamento –, é bastante raro em decorrência do uso do laser CO2 fracionado. Existem dois tipos de hipopigmentação: a verdadeira, quando ocorre perda de melanina após um resurfacing muito agressivo, acompanhada de infecção local ou dermatite de contato; e a pseudo-hipopigmentação, que se apresenta na forma de uma coloração mais clara da pele tratada. No primeiro caso, outra causa aventada é de abuso da hidroquinona antes da conduta. O tratamento é longo e trabalhoso e pode ser feito com lasers não ablativos, Excimer Laser, microenxerto de melanócitos ou micropigmentação com maquiagem definitiva. Para evitar a pseudo-hipopigmentação, sugere-se diminuir gradativamente a densidade e a energia entre a face e a região cervical ou entre as regiões anterior do tórax e cervical e não aderir ao tratamento de unidades estéticas faciais isoladas.
HIPERPIGMENTAÇÃO – Muito comum após o uso do CO2 tradicional, é menos frequente com o fracionamento e atinge principalmente os fototipos intermediários. Manifesta-se após o primeiro mês de tratamento e muitas vezes é desencadeada por uma exposição ao sol ou ao calor. Pode ser tratada com cremes clareadores com hidroquinona.
PRURIDO – Apesar de extremamente comum e secundário ao processo de cicatrização, pode ser um sinal de infecção secundária por manipulação da pele e dar origem a cicatrizes hipertróficas. O tratamento é feito com compressas de água fervida e gelada ou spray de água termal. Podem também ser usados anti-histamínicos.
CICATRIZES – Hipertróficas ou atróficas, são mais raras após o fracionamento da luz, mas ainda assim podem aparecer sem razão aparente. São mais comuns em áreas onde a pele é mais fina, como na região cervical e periocular. As atrofias devem ser tratadas com sessões de resurfacing fracionado não ablativo (1.540 ou 1.550 nm), sendo que o Dye Laser é indicado para ambos os tipos de cicatrizes. Nos casos de cicatriz hipertrófica, outra opção é a corticoterapia intralesional.
Proteger a pele da ação solar é a principal recomendação. Após a aplicação do laser CO2 fracionado, a fotoproteção é condição sine qua non para uma completa recuperação, sem o aparecimento de manchas. Além disso, a higiene e a hidratação da pele com produtos suaves também são recomendadas. Os resultados são visíveis imediatamente após a descamação dos pontos, o que ocorre entre 5 e 7 dias depois do procedimento. A estimulação do colágeno pode estender-se por até oito meses.
O emprego do laser CO2 fracionado apresenta enormes benefícios, mas dá uma ideia falsa da ausência de efeitos colaterais. Apesar de as complicações acontecerem também entre médicos renomados e bem treinados, novos equipamentos oferecem alternativas que aprofundam o tratamento até 1.500 µm, aumentando as chances de complicações. Para todos os efeitos, a técnica, mesmo sendo o laser fracionado, permanece agressiva e deve ser tratada como tal.
ANÁLISE MICROSCÓPICA DO POLIMETILMETACRILATO
Resposta inflamatória após implante de microesferas longa duração em camundongos BALB/c:
Análise hitopatológica do sítio de implante e orgãos à distância.
IPTSP/UFG – Instituto de Patologia Tropical e Saúde Pública, Departamento de Microbiologia, Imunologia, Parasitologia e Patologia da Universidade Federal de Goiás.
AUTORES DA PESQUISA
Eduardo Luiz da Costa, Vânia Beatriz Lopes Moura, Sarah Buzaim Lima,
Ruy de Souza Lino Junior, Anália Cirqueira Milhomem Instituto de Física
LABMIC – Laboratório de Microscopia
Considerações
Análise dos produto de longa duração realizada pelo LABMIC – Laboratório de Microscopia da UFG – Universidade Federal de Goiás (Instituto de Física) – Laboratório referenciado na região Centro-Oeste na análise de materiais.
Todas as normas técnicas de análise seguidas conforme a literatura.
Tatiane de Oliveira – Pós-Doutorada em Microscopia de Materiais
Laudo técnico assinado por:
Dra. Tatiane e Prof. Dr. Jesiel Freitas Carvalho – Comitê Gestor do LABMIC/UFG.
Foi utilizado MEV – Microscópio Eletrônico de Varredura, marca JEOL
Modelo JSM 6610. Para análise de imagens e determinação dos tamanhos das microesferas de longa duração foi utilizado o programa Scandium, da Olympus Soft Imaging Solutions GmbH.
Ao longo dos anos, a versatilidade do produto de longa duração se mostrou ampla, sendo utilizado desde 1945 na odontologia para a preparação de próteses dentárias (PURICELLI et al., 2011); seu uso foi refinado para o aumento e preenchimento de tecidos moles (LEMPERLE; GAÚTHIER-HAZA; LEMPERLE, 1995, 1998;
LEMPERLE et al., 2010a, 2010b), assim como para outros fins, como: reconstruções craniofaciais após trauma facial (ABDO FILHO et al., 2011), cimento ósseo para reconstrução ou correção de fraturas (HEINI; WALCHLI; BERLEMANN, 2000; NAGAE et al., 2016; ROTH et al., 2016; LIE et al., 2016); aumento peniano (CASAVANTES; LEMPERLE; MORALES, 2016); como espessante uretral para pacientes com incontinência urinária (LEMPERLE et al., 2011), dentre tantas outras possibilidades de uso.
Devido ao fato de uma rápida progressão do uso da bioplastia, progrediram também as primeiras descrições de reações adversas ao seu uso, como granulomas tardios (LEMPERLE; GAÚTHIER-HAZAN, 2009; LEMPERLE et al., 2009); formação de abscessos e reações alérgicas (STURM et al., 2011) – estudo que envolveu outros produtos que não de produto de longa duração; toxicidade sistêmica (MEDEIROS et al., 2014) – um estudo realizado por equipe da odontologia que sabidamente não utiliza o mesmo produto que a bioplastia e aplicava o produto intravascular visando a observar as reações sistêmicas, e as possíveis migrações ou fagocitose das microesferas menores (MORHENN; LEMPERLE; GALLO, 2002; LEMPERLE et al., 2004). Tais reações adversas estão intimamente relacionadas à má qualidade da matéria-prima utilizada; erro de procedimento de implantação, que inclui variação no tamanho da agulha, distribuição irregular e variação na profundidade do implante (LEMPERLE, 2006; FUNT & PAVICIC, 2013; JESUS et al., 2015).
Diversos fatores interferem no tipo e na intensidade da reação inflamatória do organismo frente à implantação de produto de longa duração com a finalidade de preenchimento estético; dentre eles está o tamanho das microesferas do polímero, as quais devem medir entre 36-43 µm, uma vez que este parece ser o tamanho ideal para injeções dérmicas, impedindo a fagocitose e permitindo entrega e estabilização do material. Esse tamanho é aceito e sustentado por relatos da literatura que mostram que microesferas com diâmetro menor que 20µm desencadeiam resposta inflamatória do tipo granulomatosa, além de serem comprovadamente fagocitadas (MORHENN; LEMPERLE; GALLO, 2002), e maiores que 50µm não seriam implantados de forma eficiente (LEMPERLE et al., 2004; LEMPERLE, G; GAÚTHIER-HAZAN, 2009).
Segundo estudo realizado na Universidade Federal de Goiás (UFG) em 2016, as microesferas de produto de longa duração, muito utilizado por médicos no Brasil, obedecem à média de diâmetro ideal para sua melhor fixação, como é mostrado nas Figuras 1 e 2. A análise da dispersão de tamanhos de partículas de longa duração revelou que a maioria das partículas (90,3%) estão no intervalo de tamanho entre 35 e 40 µm, apresentando diâmetro médio de 37,5 µm.
Vinculado ao tamanho das microesferas injetadas, outro fator que interfere na estabilidade do produto implantado, e consequentemente na reação inflamatória desencadeada, é a quantidade de deposição de colágeno ao redor das microesferas do polímero; esferas com diâmetro de 100 µm desencadeiam a produção de apenas 56% do tecido conjuntivo fibroso ao seu redor, enquanto esferas com diâmetro médio de 40 µm promovem o crescimento de cerca de 80% de fibras colágenas. Quanto maior a estabilidade do polímero, menor a probabilidade de dispersão e consequente resposta inflamatória exacerbada (LEMPERLE et al., 2010a, 2010b).

Figura 1. Partículas de polimetilmetacrilato e medidas de seus diâmetros.
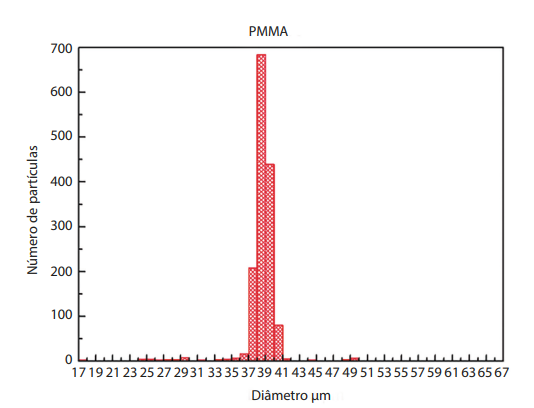
Figura 2. Histograma representativo da distribuição de tamanhos de partículas de produto de longa duração.
Por conta de todos esses fatores relacionados às microesferas e que interferem diretamente no resultado da implantação do produto de longa duração, algumas das marcas comercializadas mundialmente desse polímero, para seu uso em bioplastia, têm sua eficácia e segurança testadas e discutidas por muitos pesquisadores (LEMPERLE; MORHENN; CHARRIER, 2003; SOUSA et al., 2008; PIACQUADIO; SMITH; RUSELL, 2008; LEMPERLE et al., 2010a, 2010b;
COSTA et al., 2016). Lemperle, Morhenn e Charrier (2003) analisaram e compararam dez desses produtos (Zyplast®, Restylane®, Artecoll®, PMS 350®, New-Fill®, Reviderm Intra®, Dermalive®, Aquamid®, Evolution® e Radiance FM®), no que tange a sua biocompatibilidade e durabilidade; e constataram que todas as substâncias, reabsorvíveis ou não reabsorvíveis, mostraram-se clínica e histologicamente seguras; mesmo descrevendo reação inflamatória leve tardia, além de reação granulomatosa, os autores não atribuíram tais alterações celulares ao implante dos polímeros.
Outro estudo realizado por Sousa et al. (2008), em que implantaram produto de longa duração em camundongos BALB/c e analisaram a presença de resposta inflamatória frente à implantação, além de avaliar a deposição de colágeno; os autores concluíram que a implantação intramuscular de Newplastic® promoveu deposição de colágeno, mas não induziu inflamação crônica, o que demonstra a biocompatibilidade desse material para fins de bioplastia.
Piacquadio, Smith e Rusell (2008) objetivaram, em seu estudo, comparar 4 marcas de preenchedores faciais à base de produto de longa duração, disponíveis no mercado, a fim de determinar se havia variações significativas entre esses produtos, o que resultaria em diferentes perfis terapêuticos, dependendo da conduta do profissional, principalmente no que diz respeito à segurança. Os produtos analisados foram: Artefill® (ano de 2007, EUA); Artecoll® (ano de 2005, Canadá); Artecoll® (versão antiga 2001, União Europeia); Metacrill® (2006, Brasil); NewPlastic® (2006, Brasil). Os resultados apontaram diferenças significativas tanto entre a mesma marca, de versões diferentes, como entre marcas distintas; tais resultados demonstram que o uso desse polímero não pode ser generalizado, sendo necessário que o profissional que o manuseia tenha completa consciência da marca utilizada e das suas diferenças estruturais e reacionais em relação às outras.
Em 2010, LEMPERLE et al. avaliaram de forma detalhada a ação e consequência da implantação de ArteFill® (antigo Arteccoll e atual BellaFill) e descreveram o mecanismo de ação desse polímero, de que forma ele estimula a produção de colágeno com o auxílio do seu veículo (colágeno bovino), que devido sua viscosidade e características estruturais facilita a melhor distribuição das microesferas; relataram também as diferentes técnicas de injeção do produto que interferem diretamente na distribuição ideal do material, além da necessidade de padronização do volume implantado dependendo do local. Descreveram também as alterações faciais em que se indica a utilização de produto de longa duração para seu tratamento como dobras nasofaciais, linhas retas da testa, dentre outras; além das complicações ocasionadas por erros de técnica, como granulomas, reações alérgicas, vermelhidão e cicatriz hipertrófica.
Diante da ampla utilização do produto de longa duração em bioplastia pelo mundo e da visível necessidade de padronização de seu uso, profissionais brasileiros se reuniram em 2016 no 1.o Consenso Brasileiro de Implantes Infiltrativos (2016), quando foi amplamente discutida a utilização do produto de longa duração no Brasil nos últimos 20 anos, com o objetivo de esclarecer e uniformizar o emprego desse polímero em bioplastia. Segundo levantamento realizado nesse evento, mais de 87 mil pessoas no Brasil receberam implante de produto de longa duração, sendo mais de 71 mil implantes faciais e mais de 12 mil implantes corporais, envolvendo tanto objetivos estéticos como reparativos. Dentre os pacientes que buscam a bioplastia para fins estéticos corporais, 88% deles querem alterar a morfologia, por meio da adequação volumétrica dos glúteos. Para que isso seja possível, costuma-se aplicar de 100 a 150 cc de volume em cada etapa do procedimento, de forma intramuscular.
Resultados preliminares de um estudo ainda em andamento na Universidade Federal de Goiás, onde pesquisadores implantaram produto de longa duração intramuscularmente em camundongos BALB/c e avaliaram histopatologicamente as reações do organismo do animal frente ao polímero, mostram que, após 7 dias de implantação era visível observar intenso infiltrado inflamatório predominantemente polimorfonuclear, bem como de matriz extracelular provisória, características clássicas de inflamação aguda, o que evidencia a capacidade do procedimento de implantação e do próprio polímero de suscitar tal processo. Interessantemente, aos 30 dias após o procedimento de implantação, a região de instalação do produto de longa duração apresentava-se reorganizada, com remodelamento do tecido muscular bem como da matriz extracelular; as microesferas do polímero estavam rodeadas de colágeno depositado, mostrando-se mais bem alicerçada. Essas comprovações estão ilustradas na Figura 3.
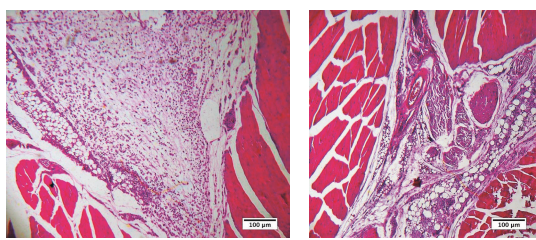
Figura 3. Fotomicrografias do músculo gastrocnêmico de camundongos BALB/c implantados com Linnea Safe® intramuscularmente, após 7 (A) ou 30 (B) dias da implantação. A – Intenso infiltrado inflamatório polimorfonuclear associado a matriz extracelular provisória ao redor das microesferas de produto de longa duração. B – Reorganização do tecido, com as microesferas contidas por depósito inicial de colágeno, infiltrado inflamatório moderado e pleomórfico. Coloração H&E. Realizado por IPTSP/UFG.
Na microscopia eletrônica de varredura é possível observar polímeros uniformes com o mesmo tamanho médio (40 micrômetros) e superfície lisa. Após contagem e medida dos polímeros, foi observado que 90% estão no tamanho correto (em média 39,5 micrômetros) nesta amostra. Para esta pesquisa foi usado Linnea Safe.
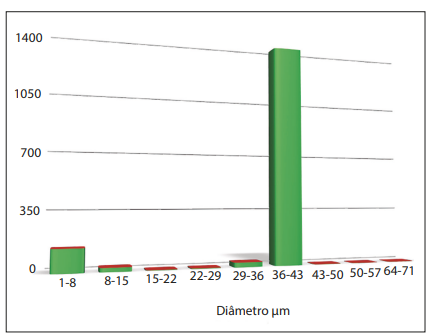
Gráfico 1. Resultados: Avaliação do tamanho das partículas de produto de longa duração.


Figura 4 e 5. UMSS – Uniform Microspheres Smooth Surface. Linnea Safe 30% – Apresentou 88% das microesferas entre 30 e 43 micrômetros. Produto com aspecto homogêneo e microesferas concentradas que se utiliza da tecnologia UMMS (Uniform Microspheres Smooth Surface – Microesferas uniformes de superfície lisa). Análise realizada pelo Laboratório de Microscopia (Labmic), da UFG.

Implante em camundongos:
• Camundongos isogênicos BALB/c, fêmeas, com idade variando entre 4 e 8 semanas, criados e mantidos no biotério do IPTSP / UFG.
• Dois grupos de camundongos assim subdivididos:
• Grupo 1: 35 camundongos divididos em 7 grupos de 5 individuos. Implantado 1 microlitro = 0,1 ml de produto de longa duração 30% no músculo gastrocnêmico do membro posterior esquerdo, com microcânula.
• Grupo 2: 21 camundongos divididos em 7 grupos de 3 indivíduos.
Inoculados com 1 microlitro = 0,1 ml de solução salina a 7%.
A eutanásia foi realizada com 3, 7, 15, 30, 60, 90 e 120 dias, respectivamente.
Esta pesquisa foi desenvolvida de acordo com os princípios éticos da Sociedade Brasileira de Ciência em Animais de Laboratório.

Macroscopia das vísceras e da pata posterior
Os blocos foram cortados em fragmentos de 5 micrômetros de espessura, corados por hematoxilina-eosina (H&E) e Picrosírius (apenas para o músculo). Foram realizados 10 cortes seriados nas vísceras em topografia de hilo. As lâminas foram avaliadas em microscopia de luz. As imagens foram digitalizadas e analisadas de acordo com o software Image J.
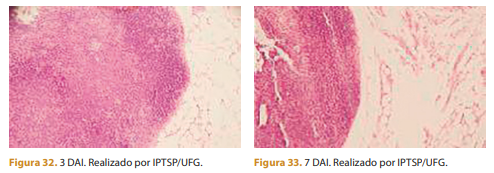
Resultados: Resposta inflamatória induzida pelo implante intramuscular. A seguir é possível notar como a resposta inflamatória induzida pelo produto de longa duração atua em um implante intramuscular.
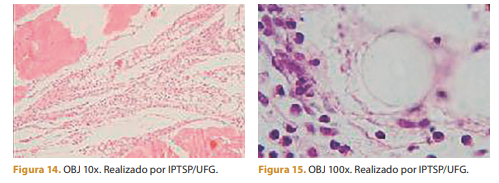
Três dias após a aplicação é possível observar processo inflamatório intenso com predominância de células polimorfonucleares.
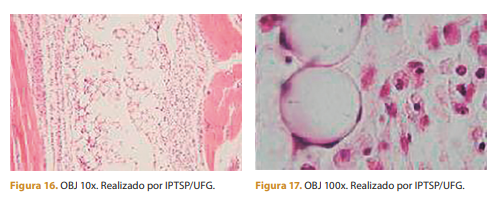
Sete dias após a aplicação ainda é possível observar quantidade acentuada de células polimorfonucleares e moderada quantidade de células mononucleares. Nota-se também que o polímero está rodeado por células.
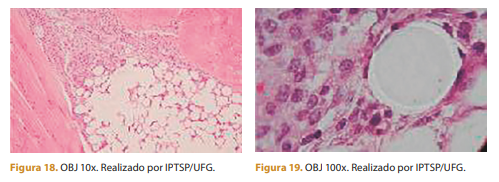
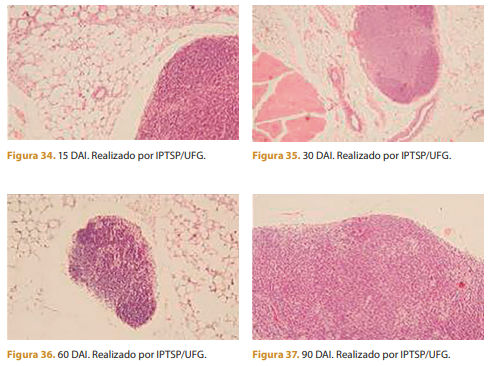
Após 15 dias da aplicação, observa-se infiltrado inflamatório leve de células mononucleares (macrófagos) e uma formação discreta de tecido conjuntivo.
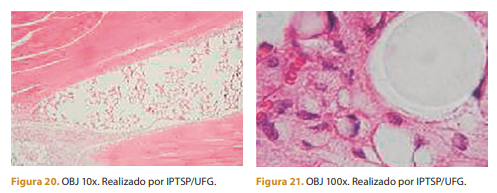
Trinta dias após a aplicação ainda se observa infiltrado inflamatório leve de células mononucleares (macrófagos) e aumento da formação de tecido conjuntivo. Polímero rodeado por tecido conjuntivo e infiltrado inflamatório discreto de células mononucleares (macrófagos).
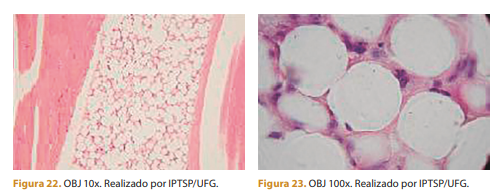
Em 60 dias, observa-se menos infiltrado inflamatório de células mononucleares e tecido conjuntivo moderado. Polímero rodeado por tecido conjuntivo e menos células mononucleares. As microesferas estão mais alinhadas e organizadas e o resultado é notável. Este é o momento ideal para fotografar o paciente e comparar os resultados Após 60 dias, também é o momento ideal para começar a fazer ajustes ou complementos; o procedimento inicial pode ser necessário.
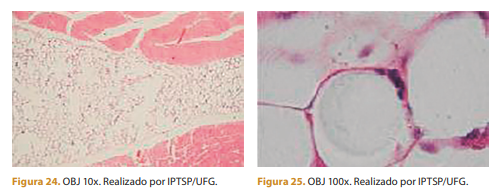
Com 90 dias, observa-se menos infiltrado inflamatório de células mononucleares e tecido conjuntivo moderado. Polímero arredondado por tecido conjuntivo e menos células mononucleares.
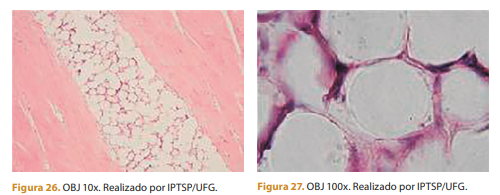
Após 120 dias, observa-se menos infiltrado inflamatório de células mononucleares e tecido conjuntivo moderado. Polímero arredondado por tecido conjuntivo e menos células mononucleares.
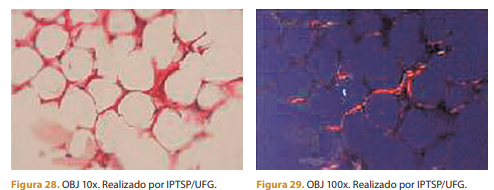
Nesta imagem, pode-se ver a coloração do picrosírius, que identifica a deposição de colágeno tipo I, que liga microesferas (polímeros) por luz polarizada.
Resultados: Análise histopatológica das vísceras
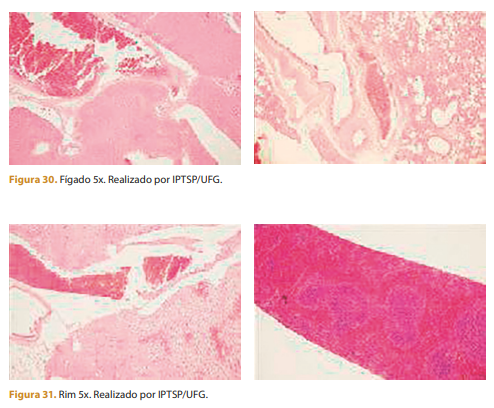
Linfonodo poplíteo – OBJ 10X
Hiperplasia reacional – Ausência de polímero

produto de longa duraçãoO biomaterial ideal está baseado no seguinte princípio: Se o polímero tem menos de 20 micrômetros, o risco de fagocitose e migração é muito alto. Polímeros com tamanhos entre 20 e 30 micrômetros podem ser fagocitados pelo macrófago, o qual provavelmente irá morrer e causar inflamação crônica. Polímeros com mais de 30 micrômetros são seguros e o risco de fagocitose é zero; portanto, este tipo de matéria-prima é a ideal para a produção de produtos bons e seguros.
Propriedades: Por ter uma metila na posição alfa, o produto de longa duração é considerado um correlato isento de qualquer ação farmacológica. Não gera nenhum produto de degradação circulante na corrente sanguínea, inexistindo assim uma dosagem máxima de toxicidade. Pela análise da MEV, 90% das microesferas de produto de longa duração estavam entre 36 a 43 micrômetros, com média de 39,5. As microesferas desencadearam um processo inflamatório agudo de 3 a 15 dias após a inoculação, evoluindo para inflamação crônica não granulomatosa, com deposição de colágeno e reorganização do tecido.
Não foram observadas alterações histopatológicas no grupo-controle. Não foram observadas microesferas em nenhum dos 10 cortes de vísceras, em todos os grupos, ao longo de todo o período analisado. Não foram encontradas microesferas de produto de longa duração nos linfonodos poplíteos, porém foi observado aspecto reacional em fases iniciais do estudo, o que é esperado em qualquer processo inflamatório. Com base nas análises do presente estudo, o produto comportou-se como um biomaterial seguro e estável.
Ver Capítulos
Introdução
Em busca da fonte da juventude
Primeira Parte: CONCEITOS DE BELEZA
Anatomia ósse da face
Anatomia da pele
Beleza e Atratividade
– Por que achamos alguém bonito?
– Sequência de Fibonacci
– Estética áurea
– Para pensar
Etiologia do envelhecimento
– Como nos tornamos senis?
– Telômeros e senescência
– Isto é surpreendente!
– Vida útil em discussão
– O equilíbrio da imunidade
O envelhecimento cutâneo
– Fisiopatologia
– Achados clínicos
– Medidas preventivas
– A importância do bom-senso médico no tratamento estético
Transtorno dismórfico corporal
– Etiologia
– TDC e procedimentos estéticos
O potencial de transformação dos fillers
– Condições ideais para um bom produto de preenchimento
– O que é o preenchimento
– Lifting X Ressurfacing
– Técnicas de volumetria
O que a ciência promete para o futuro?
Segunda parte: PREENCHEDORES MAIS USADOS
Não permanentes
Permanentes ou não absorvíveis
Características gerais
Polimetilmetacrilato
Ácido hialurônico
MD Codes
Ácido polilático
– Utilização dos fios de ácido polilático
Hidroxiapatita de cálcio
Hidrogel
Silicone líquido injetável
Outros tratamentos associados a preenchimento
– Toxina botulínica
– Laser CO2 fracionado
Adendo: Análise microscópica do polimetilmetacrilato
Terceira parte: O PASSO A PASSO DA TRANSFORMAÇÃO
Uma plástica minimamente invasiva
O instrumental que se usa
O procedimento e a “mão” do médico
Tipos de anestesia
Perigos do procedimento com preenchedores em geral
Topografia facial e riscos do preenchimento
Complicações e como gerenciá-las
Quarta parte: PROCEDIMENTOS FACIAIS E CORPORAIS
Preenchimento facial
Preenchimento das maçãs do rosto
Preenchimento de rugas, sulcos faciais e cicatrizes
Rinomodelação com preenchimento
Preenchimento da mandíbula
Preenchimento labial
Preenchimento do mento
Preenchimento de pálpebras
Preenchimento peitoral
Preenchimento de glúteos
Preenchimento em lipodistrofia
Bioplastia genital
– Bioplastia e técnicas para aumento do pênis
– Bioplastia de saco escrotal
– Bioplastia de glande
– Bioplastia de vulva
– Bioplastia de clitóris
– Bioplastia de reconstrução após mudança de sexo
Poliomielite
Síndrome de Parry Romberg
Tratamento de celulite e irregularidades cutâneas
Goldincision – Tratamento com subcisão e preenchimento com PMMA
Quinta parte: ASPECTOS JURÍDICOS
A Anvisa e os produtos aprovados por ela
Direito e Medicina
A lei e o uso de implantes líquidos
O Código de Ética Médica
Ciência e Arte do Preenchimento é o primeiro livro do Dr. Roberto Chacur. Na publicação, o Dr. Chacur reúne sua experiência para mostrar a ciência por trás do preenchimento e o requinte da arte na hora de trabalhar harmonização facial e corporal.
